Our Institute
Clinical Trials
Our Science
News
International Patients
- International Patients
- International patient Service Care
- Travel Arrangement and Hospital Admission
- FAQ
- Contact Us

Viralytics是一家位于澳大利亚的专注于开发癌症溶瘤免疫疗法的公司。其主要候选产品CAVATAK®是普通感冒柯萨奇病毒A21型(CVA21)的专有制剂,它会与在多类癌细胞上高度表达的特定受体蛋白结合,通过细胞裂解和潜在针对癌细胞的免疫应答,来杀死局部和转移性癌细胞。这种双重作用机制被称为溶瘤免疫疗法。
目前,CAVATAK正在作为瘤内和静脉内制剂在多项1期和2期临床试验中进行评估,包括与默沙东的重磅抗PD-1疗法KEYTRUDA(pembrolizumab)联用。根据Viralytics与默沙东子公司于2015年11月宣布的一项协议,一项研究正在评估CAVATAK与KEYTRUDA联合,用于黑色素瘤、前列腺癌、肺癌和膀胱癌的治疗。
2、 Bioverativ逾亿美元合作,开发血友病基因疗法
专注基因和细胞治疗的生物医药公司Oxford BioMedica(OXB)日前宣布,该公司与Bioverativ公司达成一项重要的新合作和许可协议,开发和生产用于治疗血友病的慢病毒载体。

该协议包括许可Bioverativ使用OXB专有的LentiVector Enabled技术和其工业规模的制造技术。 根据协议条款,OXB公司将从Bioverativ获得500万美元的预付款,以及1亿美元的多项里程碑付款。Bioverativ还将资助Oxford BioMedica的慢病毒载体血友病产品的工艺开发和扩大生产。该协议还允许双方在OXB公司生产GMP标准的血友病产品达成临床供应协议。
3、艾伯维(AbbVie)公司宣布与Voyager Therapeutics达成战略合作,将前者的单克隆抗体专精与全球临床开发能力,以及后者的腺相关病毒(AAV)载体技术相结合,共同开发直接针对tau蛋白的抗体,以治疗阿兹海默病等神经退行性疾病。

然而,目前技术上的一个局限在于,即便每周或每两周注射一次针对tau蛋白的生物制剂,依然只有少部分药物能够穿透血脑屏障,作用于大脑。艾伯维与Voyager期望能使用目前新兴的基因疗法,利用AAV递送技术,将编码抗tau蛋白抗体的遗传信息传输进大脑,在大脑中生成抗体,一劳永逸地减少tau蛋白。
▲Voyager的AAV载体平台有望在大脑内直接产生针对tau蛋白的抗体(图片来源:Voyager)
根据合作协议,Voyager将对载体进行研究和临床前的开发。之后,艾伯维会选择一个或多个载体,申报临床试验,进行临床阶段的开发。为此,Voyager在研发早期有望从艾伯维获得2.24亿美元的经费。
4、狂野的中国基因(编辑)疗法研究
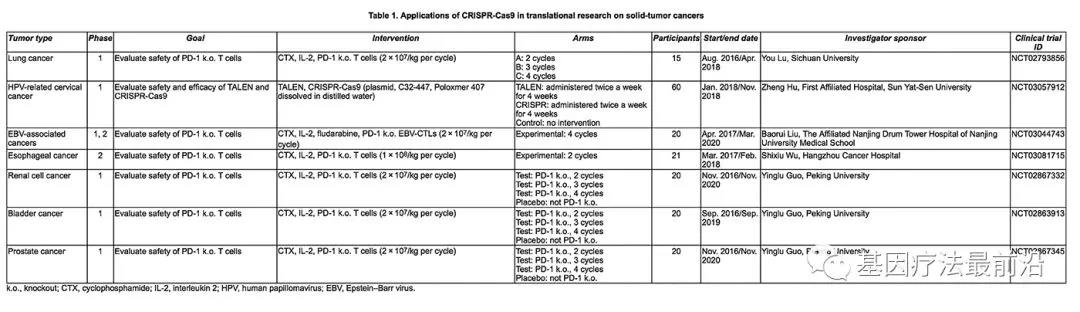
早在2016年7月,四川华西医院伦理委员会就批准了卢铀团队的临床试验研究,成为全球首例CRISPR临床试验。近日杭州市肿瘤医院院长兼任杭州市肿瘤研究所所长,吴式琇主任医师测试了一种新的治疗方法,通过对患者体内的T细胞进行基因编辑(安徽柯顿生物科技有限公司实验室运用CRISPR技术敲除T细胞的PD-1基因),使其靶向癌细胞,修饰后的T细胞回输到患者体内能够发挥抗癌作用,有效率超40%

目前,中国已经在全球生物医学研究的交流中心的一个美国政府网站上公开了至少八项关于CRISPR治疗各种癌症的研究。其中的适应症包括肺癌、膀胱癌、宫颈癌以及前列腺癌。而相比之下,在美国只有一项CRISPR癌症研究获得批准。
5、 Kite与Sangamo 30亿美元打造下一代细胞疗法
Gilead旗下公司Kite与Sangamo Therapeutics宣布,两家公司已经达成全球合作,使用Sangamo的锌指核酸酶(ZFN)技术平台开发下一代肿瘤学离体细胞治疗。

Sangamo是一家专注于将突破性的科学转化为基因疗法的公司,这些基因疗法可以利用该公司在基因组编辑、基因治疗、基因调控和细胞治疗领域领先的平台技术来改变患者的生活。该公司拥有的ZFN平台是一款强大的基因编辑技术,可用于特异性敲除基因或将治疗基因插入到精确位置。
通过此次合作,Kite将使用Sangamo的ZFN技术修改基因,来开发下一代细胞疗法,用于不同癌症的自体和异体治疗。来自健康供体细胞或可再生干细胞的同种异体细胞疗法将提供一种潜在的治疗选择,可直接在肿瘤输注中心进行,从而减少患者输注的时间。根据该协议的条款,Sangamo将获得1.5亿美元的预付款,并有资格获得高达30.1亿美元的潜在付款(基于使用Sangamo技术的10多个产品的研发、监管和推广里程碑的实现)。
6、 攻克递送难关,CRISPR疗法有望进入临床
开发CRISPR/Cas9基因编辑疗法的生物医药公司Intellia Therapeutics宣布,一项临床前研究结果于近日发表在《Cell Reports》期刊上。 在这项临床前试验中取得的出色结果,也有望助力CRISPR/Cas9技术进入人体临床试验。

转甲状腺素蛋白淀粉样变性(ATTR)是由TTR基因中约136个不同遗传突变之一引起的慢性进行性和衰弱性疾病。由这些基因突变引起的异常蛋白质沉积可影响外周和自主神经系统,导致患者在20岁左右时发生各种症状。
Intellia的体内定点项目使用脂质纳米粒子(LNPs)将CRISPR/Cas9组合递送到肝脏。该公司在体内靶向ATTR的研究项目与Regeneron Pharmaceuticals共同开发。Intellia旨在实现对肝细胞内的突变TTR基因特定DNA实施敲除编辑。这些基因可导致心脏,神经和其他组织中破坏性运甲状腺素蛋白沉积。
7、Ionis公布了亨廷顿舞蹈病临床试验的初步结果。该疗法利用 “基因沉默”或反义的技术让46例亨廷顿舞蹈病患者中的亨廷顿蛋白水平降低 - 这是有史以来第一次!这个涉及多国多中心的试验,“我们看到的结果和所期望的一样好,” 在加拿大领导这项试验的不列颠哥伦比亚大学的Blair Leavitt说。
治疗需要大约40分钟,需要将大号针插入脊柱,以便让脊液可以将药物运送到大脑。看到了这个新疗法的潜力,瑞士制药巨头罗氏已经捷足先登,将与Ionis合作继续开发这种药物。此外,试验的下一阶段将持续更长时间,并计划在北美地区招募数百名患者。如果试验成功,这个新疗法将会尽快用于治疗患者,可能在患者还没有显示症状之前,Lonis制药的高管表示。获得了世界首个基因疗法治疗罕见病的Spark公司,也不示弱。这家公司正在用基因技术来尝试治疗亨廷顿氏病。
8、生物技术公司Avrobio已经完成6000万美元的B轮融资,用于推动数项基因疗法的开发,其中包括AVR-RD-01,这是一种针对法布雷病(Fabry disease,FD)、拟采用单剂量给药的慢病毒基因疗法。
9、基因疗法初创公司Generation Bio近日宣布完成了1亿美元的B轮融资。所得款项将用于推动Generation Bio前两种候选药物的临床研究申请(IND),以及其他针对视网膜、中枢神经系统和肺部遗传疾病的计划。Generation Bio于2016年在美国马萨诸塞州的剑桥市创立,这家公司的创立基于Rob Kotin博士的研究。Kotin博士曾是美国国立卫生研究院(NIH)的高级研究员,发现了一种非病毒的基因转移新方法,称为封闭式DNA或ceDNA。
10、专注于基因治疗的公司MeiraGTx宣布,欧洲药品管理局(EMA)已授予其基因治疗候选产品A002优先药品(PRIME)资格,用于治疗因CNGB3基因突变而导致全色盲的患者(ACHM) 。值得一提的是,该药物刚刚获得美国FDA颁发的罕见儿科疾病药物(Rare Pediatric Disease)资格,用于治疗ACHM,并从FDA和EMA获得孤儿药资格。
11、 临床阶段基因治疗公司Nightstar Therapeutics plc(纳斯达克股票代码:NITE)今天宣布启动STAR临床3期注册试验以研究NSR-REP1在无脉络膜症患者中的安全性和疗效。在32例接受NSR-REP1治疗的患者数据中,经过四项开放标签的1/2期临床试验,超过90%的治疗患者在一年的随访期内维持或改善了视力。
12、近期,宾夕法尼亚大学传来消息,基因疗法“又下一城”,对于治疗遗传性失明(卵黄状黄斑变性)有较好效果,科学家预计相关人体试验将在2年内进行。
13、专注于开发针对严重神经疾病的基因治疗的公司Voyager Therapeutics公布了其正在进行的VY-AADC(VY-AADC由腺相关病毒-2衣壳和启动AADC基因表达的巨细胞病毒启动子组成,可以将AADC基因直接递送至多巴胺受体所在的壳核神经元中,绕过黑质神经元,使壳核中的神经元表达AADC酶,将左旋多巴转化为多巴胺)剂量范围1b期临床试验在晚期帕金森病中的长期数据。
这项研究的最新结果表明,在一次性施用基因疗法后,患者的多个运动功能测量都得到持续、剂量依赖和时间依赖的改善。这些测量包括患者报告的日志、帕金森病评分量表、生活质量和在12个月时无麻烦性运动障碍的开启期日志。结果还包括队列1患者报告的从基线到3年的无麻烦性运动障碍开启期持续2.1小时的改善,队列2从基线到18个月的持续和有临床意义的3.5小时改善,以及队列3从基线到6个月的1.5小时改善,且从6个月持续到12个月。

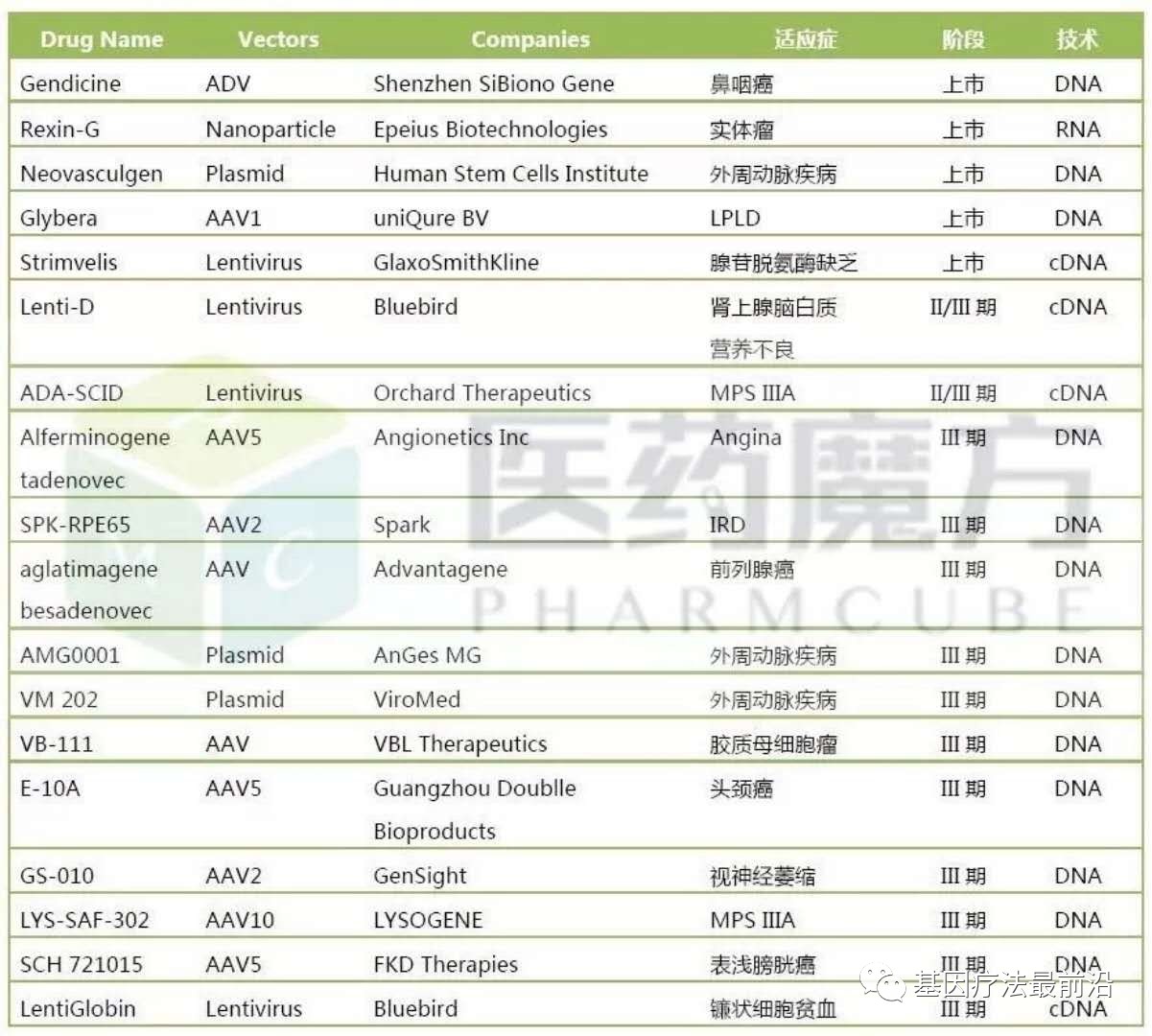
相比基因治疗,细胞治疗更是火的一塌糊涂,随着Kite、Juno、诺华等公司的产品获批上市,中国细胞疗法的临床申报也不断增加(目前已有9家企业受理),临床试验占据全球47%, 仅次于美国,相关投资并购交易呈现井喷状态。
细胞治疗领域最近发生的两起并购分别是Gilead以119亿美元收购Kite、Celgene以90亿美元收购Juno,这些都预示着细胞治疗公司数据迅速增长。但是由于细胞疗法价格昂贵,至今也没有较好的销售表现。
目前细胞治疗主要运用于晚期血液瘤,真正有市场需求的可能还是实体瘤,目前Kite一年可以生产约5000人份CAR-T细胞的制备供应,国内的复星凯特可以完成500人份/年的细胞治疗产品制备,这也间接决定了产品定价昂贵。
中国细胞疗法公司数量位居全球第一,不完全估计大于110家,占据全球42%份额。而且这些公司都是最近5年创立的(2012年以来)。
表1 中国细胞治疗公司一览
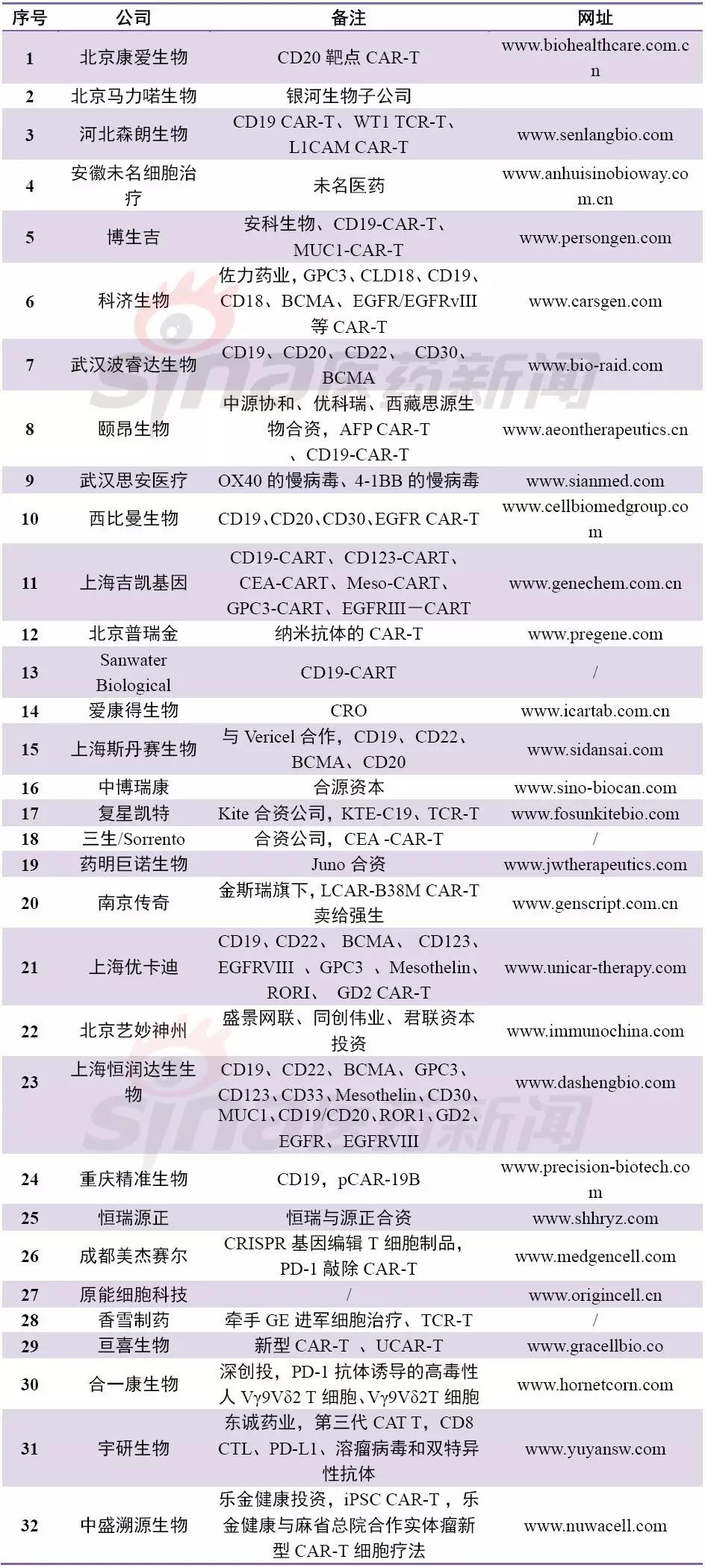
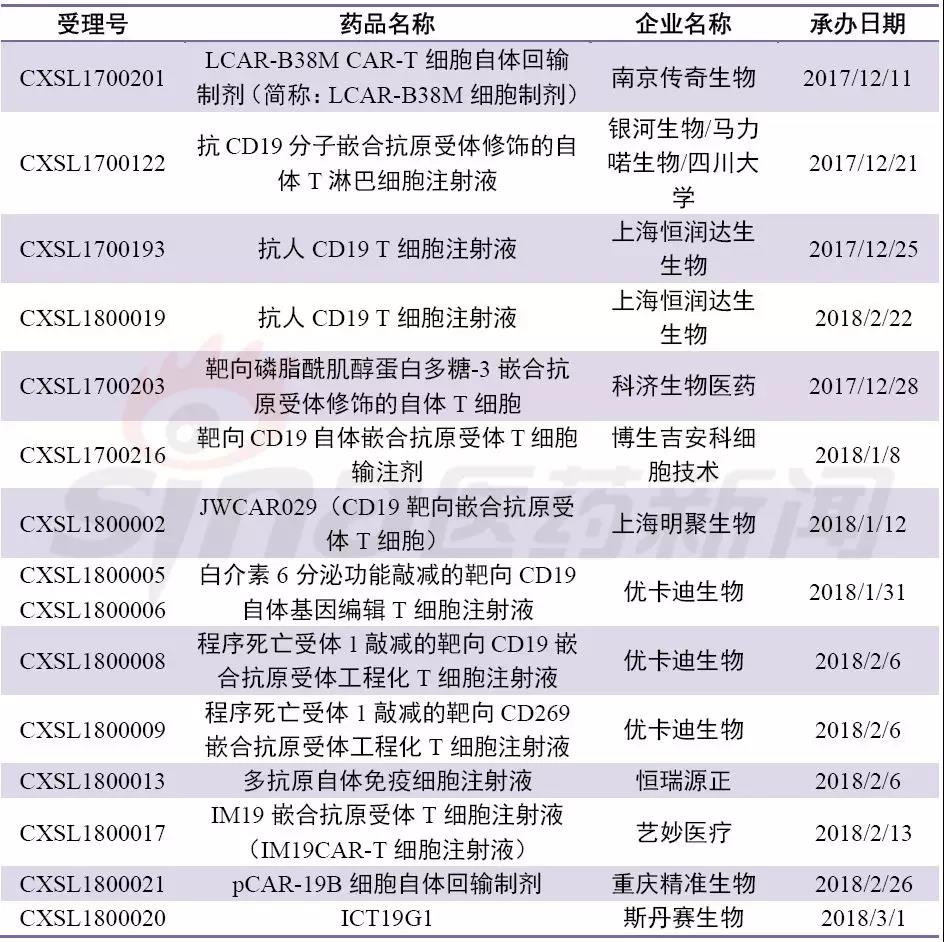
中国细胞免疫疗法自从2017年12月强生3.5亿美元牵手南京传奇LCAR-B38M CAR-T后,金斯瑞股票大涨,同时让人们看到了中国制造的弯道超车的机会。尤其在2017年12月22日,国家药审中心(CDE)发布了《细胞制品研究与评价技术指导原则(试行)》,要求细胞制品未来将按药品评审原则进行处理,随后两个月CAR-T申报临床如雨后春笋,靶点也较为集中,大部分都是CD19-CART,南京传奇也成为首个申报的细胞疗法公司。
表2 2017/2018部分细胞疗法公司融资案例
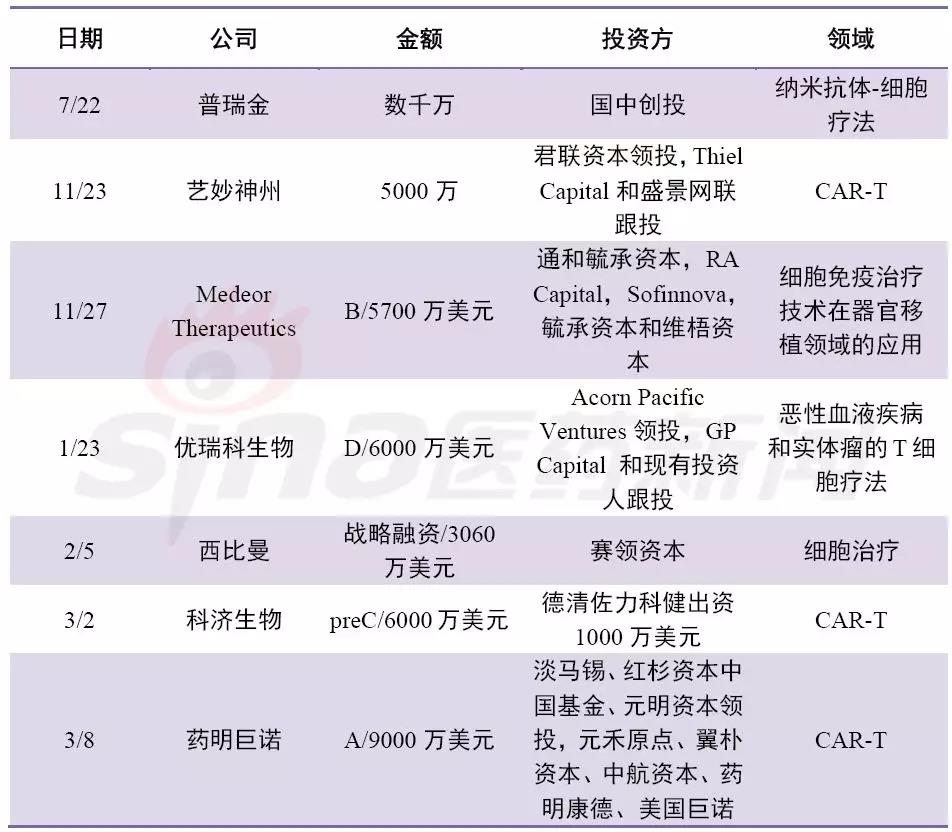
表3 国内已经申报临床的细胞治疗
不过细胞疗法与其他传统药物还是不一样,仍有许多新的问题需要解决。目前,细胞疗法靶点不是问题,主要问题是前期安全性,去年报道Juno和Kite均有脑水肿死亡事件,如何控制控制细胞因子风暴的发生成为临床医生的关注点。对于安全性,复星凯特CEO王立群博士强调了转化医学的重要性。
生物医药行业正在从传统生物药以及化学药时代进入个性化治疗时代,细胞免疫疗法未来可以与肿瘤免疫疗法共同治愈癌症,包括实体瘤等,但是需要更多有效的尝试,而不是跟风,希望以临床导向开发,避免资源过渡浪费。翻看了下每家公司,该领域还是比较急缺专业型人才,细胞疗法的路还需要2-3年。今年申报的细胞治疗有4家已经进入临床急需,获得优先审评机会。
继国内企业前赴后继布局PD-1/PD-L1研发之后,中国企业在CAR-T领域也赶上了全球步伐。
