文章转载自精准细胞治疗之家,由森朗细胞原创编译
免疫疗法的基础原理是,人体免疫系统能够识别并攻击病变细胞表面的特定蛋白质。然而这些蛋白质往往不仅存在于病变细胞表面,而且存在于正常组织细胞表面,因此可能导致所谓“on-target off-tumor”毒性,即免疫系统虽然找对了目标蛋白,却并没有正中患处。分辨同一种蛋白在病变细胞与正常细胞的不同表现对免疫疗法至关重要。
有研究表明,酪氨酸激酶受体ROR1蛋白在恶性血液肿瘤与实体瘤癌变细胞的蛋白表达上占据支配地位,在正常细胞的蛋白表达却极为微弱。这一特性本应使得ROR1蛋白成为了免疫系统理想的标靶,但是ROR1蛋白的表达出现在细胞质,而非细胞表面,大大降低了ROR1蛋白的实用性。
为了深挖ROR1蛋白的利用价值,Balakrishnan博士与Clinical Research Division的首席调查员Riddell博士协力展开试验,探索ROR1蛋白在各种肿瘤细胞与正常组织的蛋白表达规律。研究成果发表于Clinical CancerResearch杂志,研究者根据同基因或异基因ROR1蛋白在肿瘤内的蛋白表达状况,列出了容易出现“on-target off-tumor”毒性的器官,并按肿瘤的类别总结了免疫疗法的预计疗效。
研究者尝试利用免疫组织化学(IHC)方法定位ROR1蛋白,但是市面上可以购买的抗体均无法有效探测到高浓度ROR1蛋白。因此,研究者不得不使用“抗体研究中心”研发的单克隆抗体。在测试了多种单克隆抗体的有效性后,研究者选定6D4进行正式试验。
研究者从US-Biomax和人类组织细胞网络公司(Cooperative Human Tissue Network)获取了不同发病阶段的卵巢、乳腺、肺和胰腺癌癌细胞,并对癌变细胞上皮的ROR1蛋白表达进行细胞微数列(TMAs)处理。在159个受测卵巢癌变组织中, 50%的细胞在隔膜与细胞质上均出现ROR1蛋白表达,92%的病变组织为纯ROR1表达。ROR1在三阴性乳腺癌(TNBC)与肺腺癌各亚种的蛋白表达高达74%。 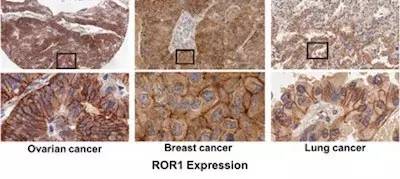
此外,该试验还有其他新发现。首先,40%的ROR1阳性癌症患者在出现癌细胞转移后反而变成ROR1阴性,意味着ROR1本身与癌细胞转移无关。其次,虽然统计数据表明胰腺癌患者的ROR1多半呈阳性,但胰腺肿瘤细胞的ROR1蛋白表达却普遍较低,这一现象非常值得关注。原先被认为ROR1蛋白表达强烈的抗体,在实际测验后却发现ROR1保持低值,意味着这些肿瘤细胞可能不适用于以ROR1为标靶的免疫疗法。
虽说该试验仍需继续深入,但正如作者所说的,“如果用CAR-T细胞疗法治疗三阴性乳腺癌(TNBC)与肺腺癌各亚种的话, ROR1蛋白是绝佳的标靶。西雅图癌症护理联盟(SCCA)已经开始了以ROR1为标靶治愈实体瘤的临床试验,该试验同样采用了ROR1 6D4抗体。”
该试验还研究了ROR1在正常组织表面的蛋白表达。先行研究表明,只有在脂肪细胞和病变过程中的B细胞表面,ROR1表达才会受到限制。本次试验验证了ROR1在正常的副甲状腺、胰岛和胃肠道各部的状况。值得注意的是,在脑、肺、心脏和肝部均未探知ROR1的存在。然而,ROR1在无癌变细胞的蛋白表达比理想值要高,使用以ROR1为标靶的CAR-T细胞进行癌症治疗可能存在安全隐患。
为了解除这一疑虑,研究者对非人类灵长类动物进行了试验。在该实验室先前的试验中,研究人员已证明有能力控制健康动物体内的ROR1 CAR-T细胞,保证试验动物的生命安全。本次试验发现,ROR1在灵长类动物正常细胞中的表达规律与人类相似,没有出现毒性,打消了公众对以ROR1为标靶的CAR-T细胞疗法安全性的疑虑。研究人员解释道,呈ROR1阳性的非肿瘤细胞抗体量不足,难以吸引CAR-T细胞对其发动攻击,因此没有产生毒性。
这一研究向业界展示了,为了保证CAR-T疗法的安全性,有必要研究抗体在正常细胞组织中的表达规律,只有这样才能降低风险,准确估计毒素出现的可能性。