(www.clinicaltrials.gov Registry: NCT04085159)
神经纤维瘤病(NF)是由遗传基因改变引起的,这种改变使患者容易在神经周围形成肿瘤。 NF是一种终身疾病,它不分性别或种族影响所有人群。神经纤维瘤病分为三种不同的类型:NF1,NF2和神经鞘瘤病。神经鞘瘤是与NF2患者相同的肿瘤类型,尽管神经鞘瘤病缺乏NF2患者常见的许多临床特征。目前尚无治愈神经纤维瘤病二型或神经鞘瘤病的方法,手术是目前唯一临床方法,并且没有药物被证明可有效治疗这些种瘤。病情的管理基于个人病况发展的具体症状。
免疫基因治疗研究院近年来也已经开发多种肿瘤表面抗原特异性CAR-T细胞治疗方案,除了对血液肿瘤效果好之外,现已开展实体瘤特异CAR-T细胞治疗,也显示极好的安全性与治疗效果。CAR-T细胞治疗,靶点经由免疫组化染色或是流式染色确认靶点后,采用临床前验证的CAR设计进行规划治疗。
免疫调控基因修改之肿瘤抗原特异性T细胞和/或抗原特异性CTL细胞获取、扩增比较容易。它是利用患者自身静脉血的淋巴细胞,在体外通过肿瘤特异性相关抗原当靶点,和细胞因子的诱导,基因改造扩增成具有杀伤力的CAR-T/CTL细胞,再经静脉回输体内,从而有效的发挥杀伤肿瘤细胞的免疫效应。CAR-T/CTL是一种可以分泌各种细胞因子参与免疫作用并且具有记忆性,对肿瘤细胞等抗原靶向具有杀伤作用,并与自然细胞构成机体抗病毒、肿瘤免疫的重要防线的细胞。针对NF的免疫细胞治疗也期望看到长期免疫保护作用。
深圳市免疫基因治疗研究院开展抗原特异性T细胞治疗多年,现在针对神经纤维瘤的临床试验,已通过临床伦理委员会http://www.szgimi.org(GIMI-IRB-19006)与国际临床试验网https://www.clinicaltrials.gov登记注册 (NCT04085159),将引领国际神经纤维瘤免疫细胞治疗水平。
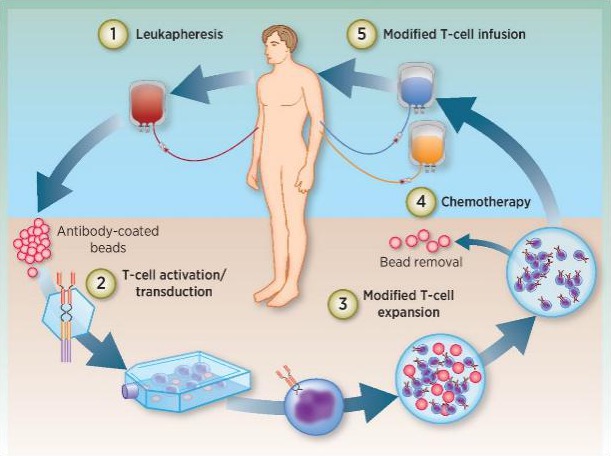
临床试验流程:
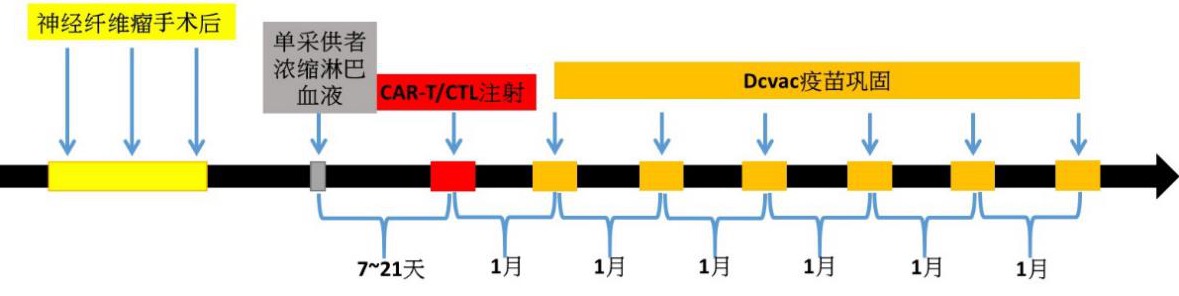
研究院根据患者神经纤维瘤二型或神经鞘瘤免疫组织染色后确定特异性靶点,利用患者自身的淋巴细胞,经体外改造成免疫调控基因修改之脑瘤抗原特异性T细胞,和/或抗原特异性CTL(CAR-T/CTL),与免疫修饰树突状细胞疫苗(DCvac)治疗神经纤维瘤(相关技术介绍可以浏览GIMI研究院网页http://www.szgimi.org)。本临床试验提出这个一贯性的免疫治疗临床实验方案,经过CAR-T/CTL免疫细胞治疗后,加上后续的DCvac的应用,具有缓解肿瘤可能及避免肿瘤复发的作用。临床试验方案用以评估不同免疫靶点在病人身上的安全性与有效性。
临床入组条件:
(1) 受试者且(或)监护人在试验开始前已签署书面同意书。
(2) 神经纤维瘤病或神经鞘瘤病的确诊。
(3) 经免疫表型分析、细胞学、基因学检测后,具有确认的靶向抗原表现,或是无检体分析但是符合已知相关共同肿瘤抗原。
(4) 受试者年龄≧1岁。
(5) 受试者必须完全遵守计划书的规范。
(6) 至少有一个可测量的NF相关脑或脊柱肿瘤且体积≥0.5cc(神经鞘瘤,室管膜瘤,脑膜瘤 - 不需要组织学确认),过去≤12个月具有进展的影像学证据,且被指定的主要目标肿瘤或与渐进性听力损失相关。
(7) 入组的渐进性听力损失标准:与之前≤1年的听力图相比,听力图显示在2个非连续或连续频率下10db HL的纯音平均值(PTA)下降,或语音识别评分(SDS)下降至95%临界差异阈值以下。
(8) Karnofsky / Lansky的表现状况(PS)为50-100%。注意:由于瘫痪而无法行走但坐在轮椅上的患者将被视为走动以评估性能评分。
(9) 受试者造血机能需符合下列条件:
(10) 血液中绝对嗜中性白血球细胞(ANC) ≥ 1,000/mm3。
(11) 血液中血小板(Platelets) ≥ 100,000/ mm3。
(12) 受试者需有良好的肝功能及肾功能:
(13) 肌酸(Creatinine) ≤2倍之正常值上限。
(14) 总胆红素(Bilirubin) ≤ 2倍之正常值上限。
(15) 麸草酸转胺酶(AST) / 丙胺酸转胺酶(ALT)≤ 2倍之正常值上限。
(16) 碱性磷酸酶(ALKP)≤ 5倍之正常值上限。
(17) 在吉尔伯特氏症候群(Gilbert’s syndrome)中,总胆红素值为2是可接受的范围。
(18) 受试者任何神经功能缺损必须稳定≥1周。
(19) 受试者的人类免疫缺陷病毒(HIV)及C型肝炎病毒(HCV)测试结果为阴性。
患者诊疗流程:
1. 患者将自身完整的病历资料进行电子档整理并发送至公众号留言中,注意需要包括疾病的主要发病历程及治疗方案、已进行过的治疗手段及疗效以及最近一次的影像学检查结果报告及医院拷贝的原始文件(如适用),尤其需要注明是否已经进行过免疫细胞治疗。
2. 专家组与患者及家属双方协商同意会预先进行靶点筛查,需要患者提供肿瘤组织白片(20片左右)或者蜡块样本,进行染色确定表达较高的特异性靶点,拟定治疗方案。
3. 根据患者所在地和病例由专家组和合作医院评估是否符合医院伦理要求及临床试验入组条件,符合入组条件的患者则可签署知情同意书后进行后续治疗。
4. 患者安排进行免疫淋巴细胞采集,研究院接收到样本后开始制备免疫细胞制剂。CAR-T制备约1周,EIE制备约1个月,癌症疫苗制备约1周时间。
5. 患者在细胞制剂回输注射前需在医院进行治疗前入院观察及预处理,细胞回输后须配合研究院随访人员,定期回传回输后的临床数据。
咨询方式:
如希望了解更多的详细信息或有兴趣参与本研究,请与我们的工作人员联系,他(她)将更为详细地介绍本研究,并安排您进行相应的检查,如您符合要求,将接受相关治疗以及随后的随访观察。通过深圳市免疫基因治疗研究院官方网站,微信公众号、既往患者或者医院医生推荐等形式获取了解研究院的相关信息,进行研究院电话咨询或微信公众号留言咨询。
官方网站:http://www.szgimi.org/
咨询电话:0755-86725195
微信公众号:szgimiirb
资料上传邮箱:gimi_trials@szgimi.org