

本文由医麦客原创,欢迎分享,转载须授权
2019年11月22日/医麦客 eMedClub/--11月18日,权威期刊Nature Cancer上发表了一篇论文,该论文针对一项三特异性抗体通过共刺激T细胞受体增强肿瘤靶向和免疫治疗作用的研究进行了综述和探讨。此课题由美国赛诺菲研发部的吴岚等人共同完成。

▲图片来源:Nature
抗体的演变史
1890年,生理学家Emil von Behring和微生物学家Shibasaburo Kitasato在接触白喉的破伤风毒素的动物血液中发现了作为保护性抗毒素的抗体,抗体由此诞生。从那时起,它就成为了一个主要的研究课题,在适应性免疫和广泛的特异性中起着关键性作用。
1975年,免疫学家Georges Köhler和César Milstein在《Nature》杂志发表了一篇关于如何使细胞产生已知特异性抗体的报道。这一发现为患有自身免疫和癌症疾病的人们带来了重大的生物学突破,为未来抗体的临床试验成功奠定了基础。由此,对一个靶标具有特异性的抗体(称为单克隆抗体)成为首个获得广泛临床应用的癌症免疫疗法。
在随后的发展中,科学家们在单克隆抗体发展的基础上研发出了双特异性抗体治疗方法:通过含有2种特异性抗原结合位点的人工抗体,在靶细胞和功能分子(细胞)之间架起桥梁,激发具有导向性的免疫反应攻击癌细胞。并通过研究取得了相应的成果。
目前,全球已有三款双特异性抗体药物获得FDA上市批准:Amgen(安进)公司的Blincyto(Blinatumomab,靶向CD3和CD19)用于治疗急性B淋巴细胞白血病;TrionPharma公司的Catumaxomab(靶向CD3和EpCAM),用于治疗癌性腹水(由于过于惨淡的市场销售情况,2017年6月官宣永久撤市);罗氏的双特异性抗体Emicizumab(靶向凝血因子X和因子IXa),用于治疗血友病。
鉴于双特异性抗体优良的免疫疗效以及广阔的发展前景,科学家们开始着手研究三抗以及多抗的治疗方法,寻求更强大的抗癌免疫疗效。近日,吴岚等人研发出了一款可使T细胞与骨髓瘤细胞紧密结合,并增强T细胞抗癌作用的三特异性抗体,它可以同时靶向CD38、CD3以及CD28这三个靶点。
推荐阅读:
基于双抗技术的三特异性抗体
众所周知,早在2014年安进公司的Blinatumomab(靶向CD3和CD19)在临床上就取得成功且获得了FDA的批准上市,它是一款同时靶向癌细胞表面的CD19抗原和T细胞表面CD3受体的双特异性抗体,在治疗晚期B细胞急性淋巴细胞白血病(B-ALL)患者时,能够将患者的缓解率和生存期翻倍。而这类双特异性抗体主要就是通过有效激活T细胞的抗癌活性发挥疗效。此款双抗中CD3作为T细胞受体(TCR)的一部分,通过结合抗原分子来识别异常细胞。
吴岚等人基于双特异性抗体技术,开发的三特性抗体可与CD3结合驱动T细胞的激活,进而导致骨髓瘤细胞杀伤,以及毒性细胞因子的产生和释放。
此外,CD38在骨髓瘤细胞上高表达,它代表着骨髓瘤治疗的诱人靶标,目前已有靶向CD38的单抗(daratumumab)被批准用于治疗多发性骨髓瘤,该蛋白也是急性淋巴样白血病和急性髓样白血病等癌症的潜在靶点;与单抗相比,含有CD38靶向的三抗在体外实验中裂解的癌细胞比例比单抗提高了3-4倍。
此款三特异性抗体与传统的双抗相比,它主要增加了一个靶点——CD28(也在T细胞上表达,三特性抗体与该蛋白结合可驱动一种名为Bcl-xL的蛋白质的表达,它可以阻断T细胞死亡,从而提升T细胞杀伤癌细胞的持久性)属于共刺激受体,对T细胞的激活有着积极的调节作用。当T细胞通过TCR识别其靶抗原后,需要一种共刺激受体(如CD28)的参与才能实现有效免疫反应所需的持续T细胞增殖。在缺乏共刺激的情况下,通过TCR引发的激活会导致T细胞处于一种“无效能”的状态,甚至在无共刺激时,通过TCR识别抗原引发长期激活会导致T细胞发生细胞凋亡。
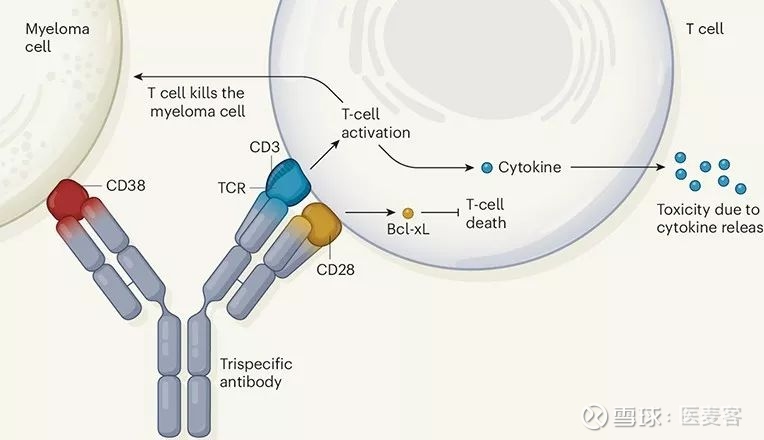
▲三特性抗体的作用机制:帮助T细胞靶向和杀伤癌细胞(图片来源:Nature)
由此,各个靶标的作用可总结为:CD3和CD28的参与提供了有效的T细胞刺激,而抗CD38结构域则将T细胞引导至骨髓瘤细胞以及某些淋巴瘤和白血病;它们的结合靶向可以有效地加强肿瘤识别和杀伤效能。
针对这一研究,宾夕法尼亚大学Alfred Garfall博士和Carl June博士专门进行了评论,并指出使用三特异性抗体治疗癌症是一个理念上的重要进步。

▲图片来源:Nature
他们还指出:利用三特异性抗体来治疗癌症是一项重要进展。作为一种灵活的技术,三特异性抗体可被用于靶向免疫调节信号的不同组合,使用这类抗体抗癌可能比全身给药更安全、比免疫单抗的用药更有效。未来,三特异性抗体有望为抗癌免疫治疗提供一条新出路。
抗体生产难关
随着免疫治疗的发展,生物制药市场对抗体在短期内生产的各种重组蛋白质的需求日益增长,从而迫切需要高效灵活的表达系统,瞬时基因表达是满足这种需求的常用方法。
多年来,人们用瞬时转染来快速且经济地制造着重组蛋白,但每个瞬态系统都受到转染效率和细胞系本身固有生产力的限制,尤其是在采用CHO细胞方面更是如此(CHO细胞的多年细胞发酵是生物制药生产过程中最常用和最完善的系统之一;它们是生物治疗蛋白(生物制剂)生产的主要宿主,大约70%的许可生物制剂在CHO中生产)。由于其作为抗体生产的优选载体,一直用于临床材料的更大规模生产,所以目前急需解决其转染问题。
解决方案
为了解决这个问题,Polyplus开发了一种先进的瞬时表达系统,即FectoCHO™表达系统,包含促进表达的新型化学限定的CHO培养基即FectoCHO™ CD表达培养基和性能强大的转染试剂FectoPRO®。

测试发现,FectoCHO™表达系统可以显著提高CHO细胞中瞬时表达蛋白质的产量,并且包含以下优点:

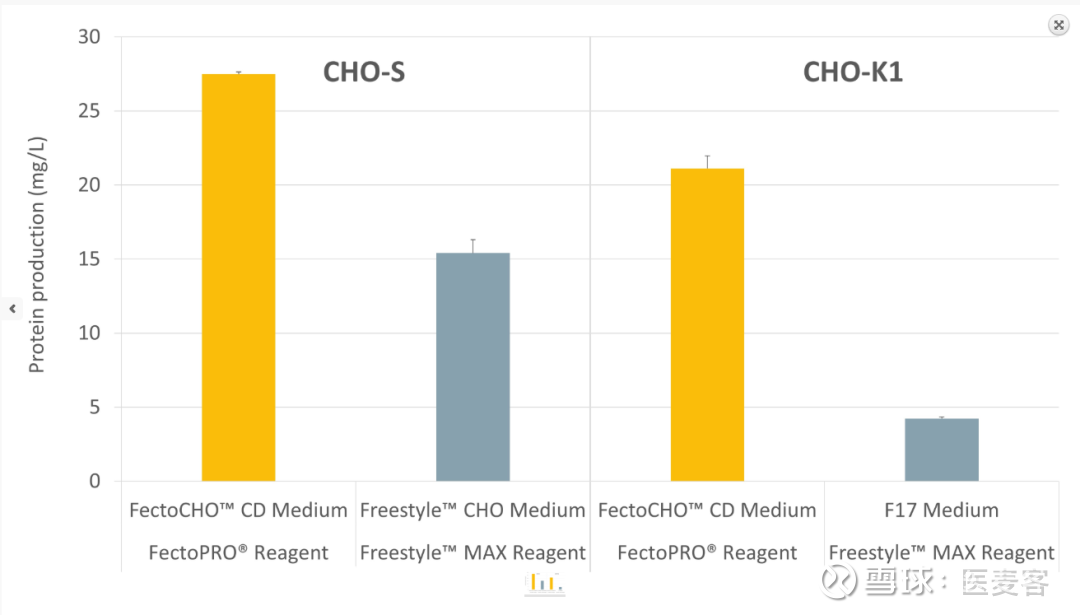
其FectoCHO™ CD表达培养基更是专门针对各种CHO细胞(如CHO-K1、CHO-S和 ExpiCHO™-S)进行优化从而使细胞的适应和培养变得极为简单:无需繁琐的适应和培养。此化学限定培养基配套FectoPRO®进行转染是最佳方案,使得采用瞬时基因表达得到最高的蛋白质和抗体产量:与竞争对手的系统相比,蛋白质产量提高了4倍。

FectoCHO™系统在悬浮CHO细胞中有着出众的蛋白质产量
专为瞬时转染和蛋白质表达优化的化学限定培养基-FectoCHO CD 表达培养基和高效的转染试剂-FectoPRO的组合,使得在各种 CHO 细胞(如CHO-S和CHO-K1)中均可得到更高的蛋白质产量。
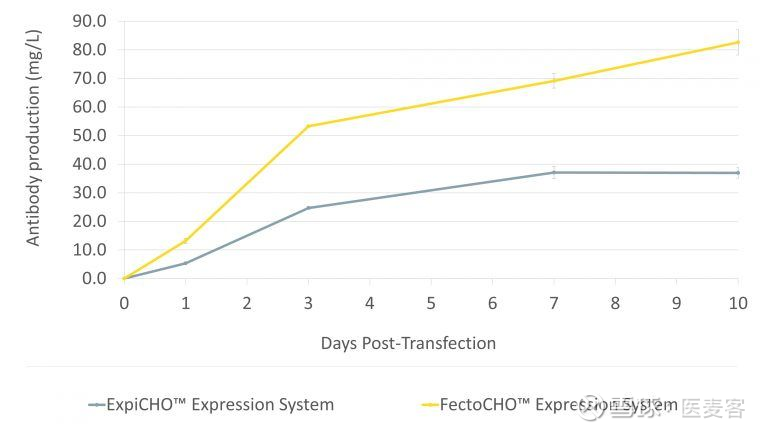
FectoCHO™系统是高密度细胞系统的理想选择
FectoCHO™ 表达系统尤其适用于高密度细胞,如ExpiCHO™-S细胞。FectoCHO™ CD培养基能够在非常高的细胞密度下维持细胞的生长和活性长达10天,配合使用FectoPRO®可保证更高的转染效率,从而使在ExpiCHO™-S细胞中得到非常高的蛋白质产量。
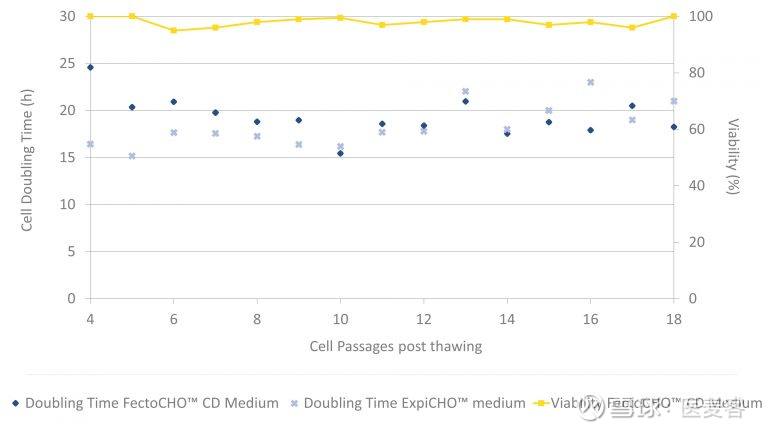
快速方便的 CHO 细胞适应
FectoCHO™ CD 表达培养基可在培养高密度CHO细胞的同时还能在倍增时间短的情况下保持出色的细胞活力。无论是何种CHO细胞,此专门研制的培养基都有着快速方便的细胞适应。细胞可在FectoCHO CD表达培养基中直接解冻细胞,再经过几次传代后即可进行转染,以达到最高的蛋白质产量,不需要连续适应培养,就可达到方便快速的细胞适应。
化学限定组分的试剂盒
FectoCHO™ 表达系统包含3个完美搭配的组分:
FectoCHO™ CD 表达培养基,










