嵌合抗原受体T细胞治疗 (chimeric antigen receptor-modified T cells, 简称CAR-T细胞),是结合T细胞与抗体标靶的先进治疗技术,是近十年来肿瘤治疗领域的重大突破,也是当今最火热的肿瘤免疫治疗之一。
多项临床研究数据表明,CAR-T细胞治疗血液系统恶性肿瘤疗效显著。患有急性淋巴白血病(B-ALL)98% 的病人,癌细胞表面带有CD19这个标记,因此CAR的设计,是将辨识CD19的抗体与活化T细胞所需的信号基因,送入患者的T细胞表达。目前抗CD19的CAR-T细胞,治疗难治复发急性淋巴细胞白血病,可以达到85%-90%以上的缓解率,然而防止复发和维持疗效是目前大家所关注的问题!
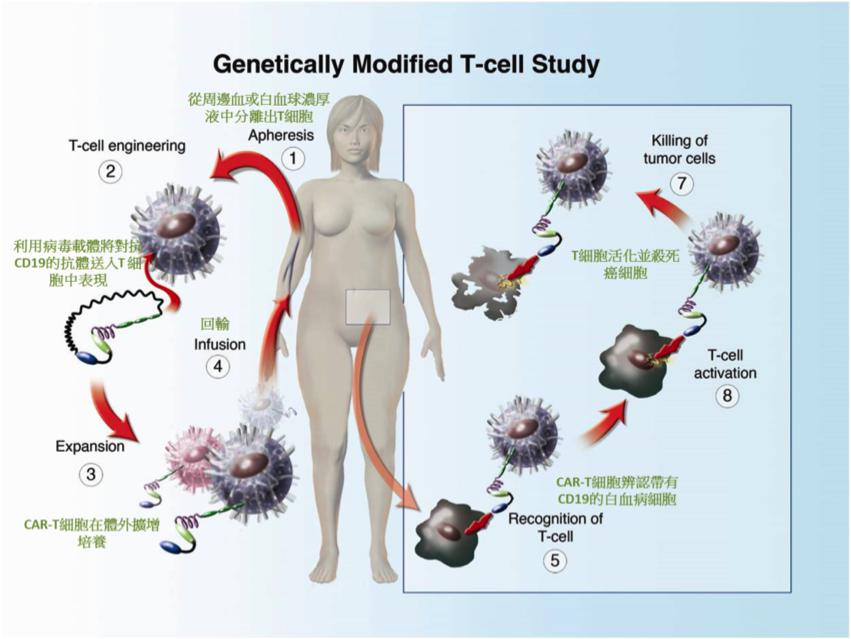
CAR-T临床治疗,成功的关键即是基因转植效率,慢病毒载体扮演了极重要角色。不同的研究团队使用的CAR虽然都是辨识CD19,但在细胞内的基因设计 (cytoplasmic portion)也是不同的,有研究证实,使用含有T细胞共刺激因子4-1BB 区的CAR,可促进T细胞增生,维持更长的疗效,显示CAR仍可做更多改良以增加疗效。但是4-1BB的CAR,短期内会造成比较严重的嗜中性球减少(neutropenia)、细胞激素(cytokine)释放、肿瘤溶解综合症、发烧、低血压等的严重免疫因子风暴反应(CRS)。虽然肿瘤细胞死亡是乐见的,但必须注意低血压以及细胞激素风暴等的副作用。另外,癌细胞也会分泌抑制因子,抑制T细胞成熟及生长,所以肿瘤附近是属于免疫抑制的环境,尤其实体肿瘤附近的抑制作用更强,如何克服这类问题,也是能否成功治疗癌症的关键。
CAR中真正关键的发明创作部份,是细胞内讯号传导区(intracellular signaling domain)。第一代CAR 仅使用CD3ζ作为细胞内讯号传导区,作用有限;第二代CAR 加入由CD28或4-1BB衍生之单一协同刺激区域;第三代CAR包含二个自CD28/4-1BB或其他协同刺激分子衍生之协同刺激区域,可造成更强的讯息传导。深圳市免疫基因治疗研究院由张隆基教授领导的团队,首先开发了第四代(4SCAR)以及第五代的CAR,并且在其中加入了安全撤除机制,和免疫调节机制,是目前最先进的设计,并且免疫风暴安全性最高的。已有多位未移植与移植后急性淋巴白血病以及淋巴瘤患者达到5年以上长期缓解!
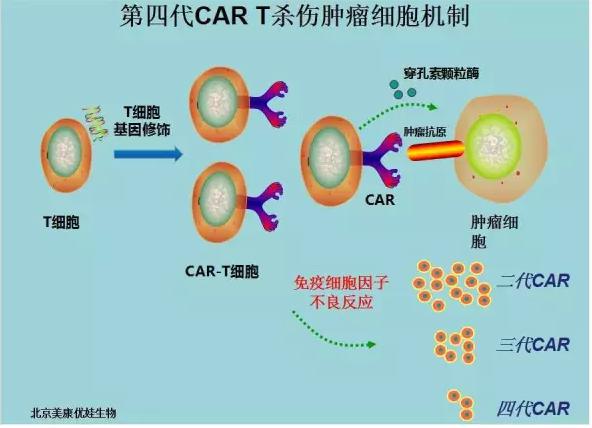
案例信息一: 移植后急淋白血病 4SCAR19-T治疗后长期缓解
深圳市免疫基因治疗研究院,北京美康公司与中国人民解放军总医院第六医学中心,于2015年合作治疗一例急淋移植后复发10岁小孩,输注4SCAR19-T细胞前原幼淋占72.8%,输注一次4SCAR19-T后,隔三天再补强一剂4SCAR19-T,输注当天没有任何临床副反应,在一周后开始有些38℃左右低烧反应,反复持续10多天,不影响生命体征,也未服用特殊药物而自然退烧。在CAR-T治疗后50天骨髓达到完全缓解。近期随访显示,仍然持续缓解中,已经长达5年半,并在周边血中持续测到低比例的CAR-T细胞。
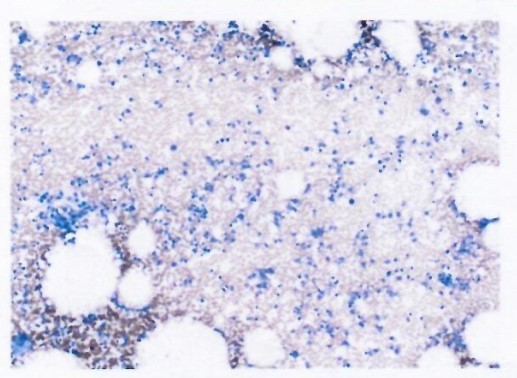
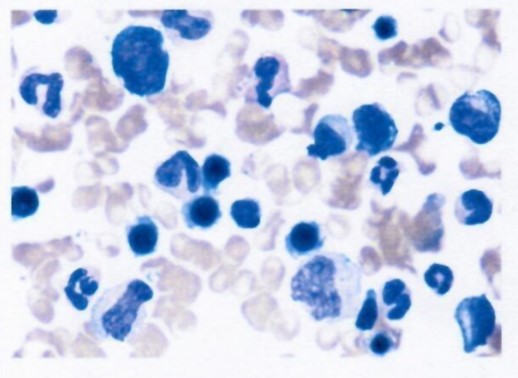
5年半后检测结果:骨髓小粒可见,单核细胞未见异常,以造血细胞为主
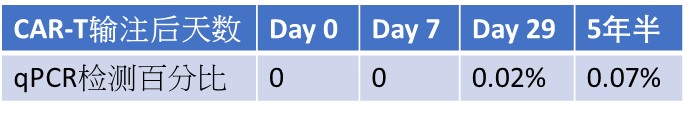
5年半后在体内仍然检测到CAR-T细胞
案例信息二: 未移植急淋白血病 4SCAR19-T治疗后长期缓解
深圳市免疫基因治疗研究院,北京美康公司与云南第一人民医院,同样在2015年治疗一名35岁成人B-ALL患者,在患者化疗前即采集淋巴细胞冻存,预备做CAR-T,之后在患者化疗缓解后进行4SCAR19-T细胞治疗。CAR-T输注前患者髓系前体细胞约占有核细胞的1.3%,其中约0.02%的细胞怀疑为肿瘤来源,此群细胞表达CD19,CD34,CD58,表明有癌细胞的残留,且癌细胞以CD19靶向为主。随后评估进行4SCAR2.0治疗方案(详情请看研究院网页http://www.szgimi.org/shownews.php?id=412),在两次4SCAR19-T输注后,患者都在2周内发生大量CAR-T细胞扩增,之后骨髓达到完全缓解。CAR-T疗程后患者除了服用伊马替尼再没接受其它治疗,近期5年后随访,这位没有接受移植的病患仍然缓解中。生活与正常健康人无异。
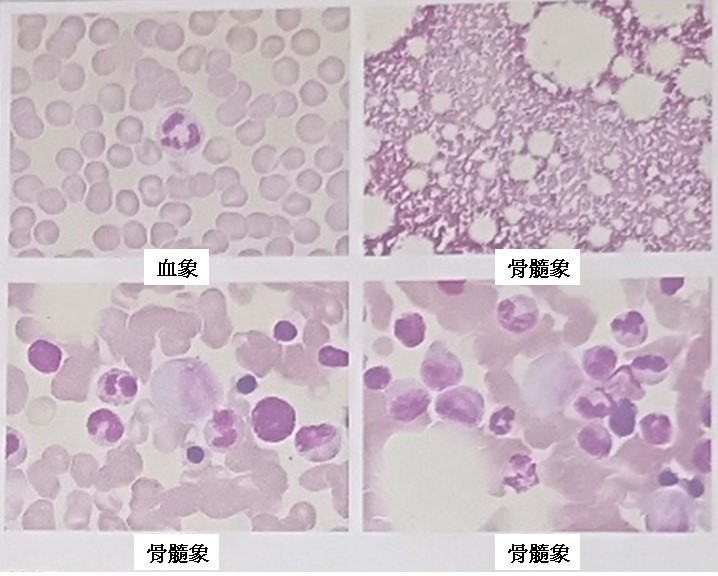
五年后淋巴细胞比例正常,形态未见异常;单核细胞比例、形态未见异常,且未见转移癌细胞
目前最热门的急性淋巴白血病的靶向免疫治疗,就是CAR-T细胞治疗,它相当于导弹,藉由单株抗体基因修改T细胞来追踪定位白血病细胞,锁定目标并启动一连串反应后,T细胞递送炸弹,摧毁肿瘤细胞,而且T细胞可以在体内分裂扩增。研究院4SCAR技术已经治疗800多例患者,累积丰富的临床经验,目前统计数据显示, 4SCAR2.0治疗方案效果好而且安全,深圳市免疫基因治疗研究院的创新4SCAR19-T细胞不仅安全,而其中记忆性T细胞,已证明可长期留存体内,对癌细胞进行监控。