急性淋巴细胞白血病(ALL)是一种常见的血液肿瘤,根据免疫学表型可分为急性T淋巴细胞白血病(T-ALL)和急性B淋巴细胞白血病(B-ALL)。其中T-ALL属于一种比较少见的造血干细胞异常的疾病,在儿科淋巴细胞白血病发生占比10-20%左右,比B-ALL更容易发生诱导化疗失败,早期易复发,且复发后难以再次缓解。儿童T-ALL发病时年龄偏大,肿瘤负荷较高,病情进展迅速。易出现纵隔肿物、外周血白细胞高、中枢神经系统浸润、睾丸浸润等临床特征。
T-ALL常规的治疗是高强度的化疗(BFM-90),但是一些复发难治患者,在经历化疗失败后,其可选的治疗方案就非常有限。近期,深圳市免疫基因治疗研究院携手深圳儿童医院联合开发新型靶向CD7第四代CAR-T(4SCAR7),并成功治疗一例急性T淋巴细胞白血病患者。
基于CAR-T细胞成功治疗B细胞淋巴瘤的经验,研究院通过一系列抗原筛选后,最终确定CD7为T细胞肿瘤靶标抗原。CD7分子是一种膜结合糖蛋白,在T-ALL中表达较高,而在正常组织中表达较弱,因此具有较高的安全性。
成功案例分享
患者11岁男童,在深圳儿童医院确诊为急性T淋巴细胞白血病,高危型。确诊后进行标准CCCG-ALL-2005方案,诱导化疗,无明显效果。之后进行高剂量HD-MTX巩固治疗,依旧无明显效果,因此采用实验治疗方案,采用4SCAR7靶向CD7进行CAR-T治疗。在输注4SCAR7细胞后的第5天背部和腹部出现斑疹和瘙痒,给予氯雷他定治疗后缓解(图1)。在第9天时,发烧(38.9 °C),第15天获得缓解。第10天和第24天均检测到4SCAR7 T细胞体内大量扩增(图2)。第17天,评估患者肿瘤达到完全缓解(CR),且残留异常T淋巴细胞(MRD)与KMT2A-MLL融合基因突变转阴。第50天时,患者接受半相合造血干细胞移植(HSCT),并且在后续3个月的随访期间,生存率良好。
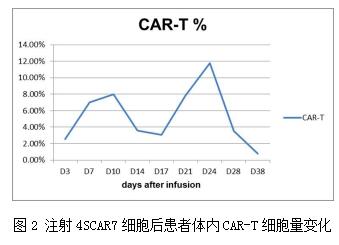
治疗过程观察淋巴细胞亚群,与输注CAR-T细胞后的增殖及炎症状态密切相关。对应患者发烧时间及CAR-T扩增情形,同样在输注CAR-T 10天后,淋巴细胞亚群计数逐渐升高,在第38天达到高峰。而患者发烧,CRS一级反应在第9天开始,相对容易处理,体内炎性细胞因子,在第15天后呈现缓解反应。
患者从输注CAR-T开始,给予常规伊曲康唑和磺胺甲恶唑;治疗期间没有严重感染,常规监测EBV、CMV序贯试验阴性,且没有出现长时间的血细胞减少。血象检测显示在第25天恢复正常。
4SCAR设计的目的是根据可诱导的Caspase9自杀基因特征,在需要时能够终止CAR-T细胞反应。然而,累积的临床经验发现,4SCAR只有轻微的细胞因子反应,大多数患者几乎没有毒性反应(CRS),且对CAR-T功能没有任何减弱的作用。
许多CAR-T细胞设计具有自相残杀的可能性,如靶向CD56的CAR-T细胞可能杀伤NK细胞,但4SCAR的设计,在体内目前为止,尚未观察到太多不良作用。同样也没有观察到患者接受CD7 CAR-T细胞后的T细胞有自相残杀效应。
4SCAR7治疗复发难治性T-ALL的效果显著,说明CD7是一个有效治疗靶点,为T-ALL的治疗提供了一个重要的解决方案与策略。 同时本研究也首次证明了在高危型急性T淋巴细胞白血病诱导失败后,4SCAR7治疗具有安全性和有效性,预期未来4SCAR7会有更多的临床成功报道。