自身免疫性疾病 (AID) 是一系列慢性疾病,源自异常激活的自身免疫系统,涉及某些器官(器官特异性 AID,例如 I 型糖尿病,T1D)或多器官系统(系统性 AID,例如红斑性狼疮erythematosus, SLE),临床表现为自身免疫不耐受并导致组织损伤。从广义上讲,AID 可以根据致病机制分为两类:自身反应免疫细胞,或“自身抗体”介导的 AID,其中抗体由 B 淋巴细胞谱系的浆细胞产生。自身免疫性疾病的发病率为每 10 万人 80 例,全球患病率超过 3%,影响了世界上大约5%-8%的人口(Chen et al., 2019),给患者造成了巨大的痛苦。
女性占所有AID患者的65%,主要发生在青年和中年女性中,是受累女性的首要死因。目前已报道的AID有近百种,其中最常见的是I 型糖尿病和自身免疫性甲状腺疾病,其次是类风湿性关节炎(RA)、炎症性肠病、红斑性狼疮(SLE)和多发性硬化(MS)。
嵌合抗原受体 T (CAR-T) 细胞是经过工程改造以表达特异性合成抗原受体的 T 细胞,该受体可以识别细胞表达的抗原,这些抗原与受体结合后,靶向细胞会被消除,已被用于治疗多种的恶性肿瘤。
自身免疫性疾病 (AID) 是一类慢性疾病,大致可分为自身抗体介导和 T 细胞介导的疾病。AID治疗的重点是消除致病免疫反应或建立免疫耐受。然而,目前的治疗方法对免疫耐受逆转作用不大;如抗 TNF-α等分子靶向生物抑制剂,也只能温和地调节免疫平衡。而通过CAR-T治疗肿瘤的思路,也为AID治疗带来新希望。
靶向CD19的CAR-T细胞治疗针对B细胞相关肿瘤的应用是癌症免疫治疗的一大进步。CAR-T 细胞的经典临床应用,是治疗复发性或难治性 B 细胞急性淋巴细胞白血病 (ALL)、难治性 B 细胞淋巴瘤和非霍奇金淋巴瘤。除了CD19靶抗原外,CAR-T 细胞也已经用于靶向其他血液学 B 细胞、浆细胞、T 细胞或髓系恶性肿瘤表面抗原靶点,如 BCMA、BAFF-R、CD20、CD33、CD70、CD79b、CD7、CD56 和 CD123等。
随着构建CAR的技术创新和临床前研究的积累,CAR-T细胞衍生的免疫治疗在AID中的应用是可期的。利用CAR-T细胞治疗AID,可以根据不同AID的特异性抗原或抗体选择CARs,让CAR-T细胞具有独特的作用,且理论上产生的副作用可预期可控制。
CAR-T 细胞在 AID 中靶向治疗的应用前景广阔。类似于通过靶向肿瘤细胞表面相关抗原,CAR-T细胞可以通过靶向致病细胞表面表达的特定自身抗原、或靶向抗体生成浆细胞和B细胞来治疗AID。GIMI研究院目前已经研发100多种CAR的设计,应用在临床的已有40多种,CAR-T使用患者已累积超过千人。自身免疫性疾病的患者不同于肿瘤病人,对生活品质与治疗副作用更为关注,更在意治疗过程中发生的过度炎症反应如免疫因子风暴(CRS),而后者也可能会造成病情加重。因此,CAR-T的毒副作用与安全系数,对AID病人的应用更为重要。GIMI研究院采用的第四代CAR-T技术,4SCAR,已经使用多年,超千例病人的临床数据累积结果显示,具有很高的安全性与极低的毒副作用,少见3级以上的毒性反应(CRS及CRES),且疗效显著,是针对AID治疗的最佳CAR设计方案。更重要的是,4SCAR设计具有自行撤除的机制(iCasp9),如果发生严重体内毒性,可以使用小分子药物(AP1903)将体内的CAR-T细胞全数清除。
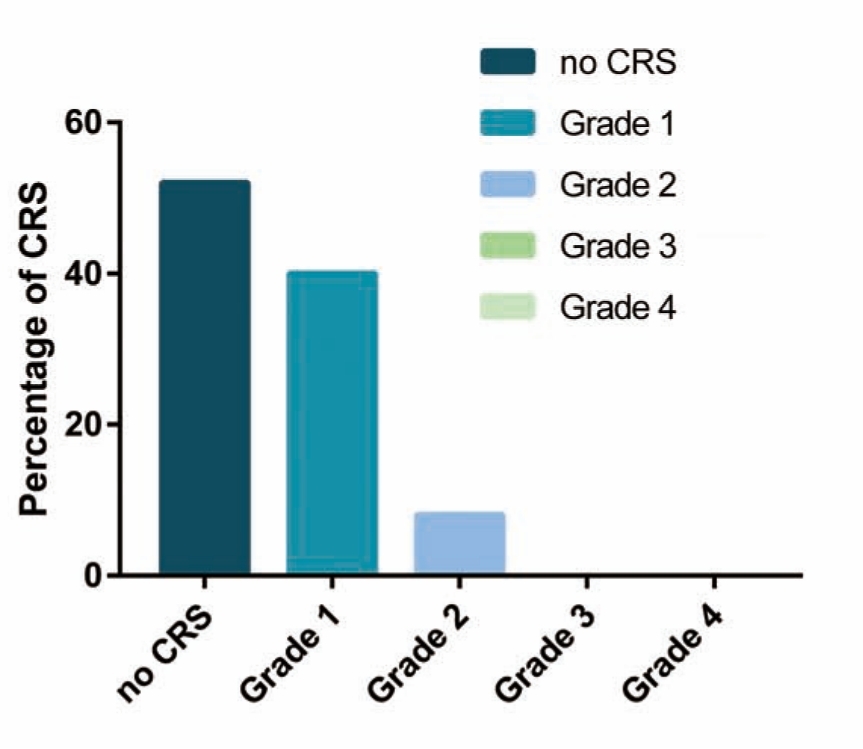
American Journal of Hematology. 2019
GIMI研究院研发的4SCAR19,4SCAR-BCMA,4SCAR138,4SCAR-BAFF-R等可通过靶向B淋巴细胞和浆细胞,去除抗体生成细胞,重新启动B细胞系统,是治疗抗体相关AID的极佳方案。AID相关疾病如类风湿性关节炎(RA)、红斑性狼疮(SLE)、多发性硬化(MS)和血管炎等自身免疫性疾病都可以使用此策略。重要的是CAR-T细胞在体内可成为记忆细胞,可能存活数年,长期监控不正常B细胞活动,或能长期控制疾病复发、恶化。传统的免疫抑制剂需要长期给药,很难持续恢复体内免疫耐受。相反的,具有极低毒性且靶向作用佳的4SCAR技术,如果在临床应用中能确认高性价比作用,或许更适合针对AID相关免疫疾病的长期治疗与应用。针对AID的CAR-T治疗,国内外许多单位已经开展实验治疗,GIMI研究院也已注册4SCAR研究项目,对国内外病患进行招募开展临床实验治疗。
参考文献:
*Jhaveri KS et al. (2020). Safety and efficacy of CAR T cells in a patient with lymphoma and a coexisting autoimmune neuropathy. Blood Adv. 4:6019-22. DOI: 10.1182/bloodadvances.2020003176.
*Mougiakakos D et al. (2021). CD19-targeted CAR T cells in refractory systemic lupus erythematosus. N Engl J Med 385:567-9. DOI: 10.1056/NEJMc2107725.
*Aghajanian H, Rurik JG and Epstein JA (2022). CAR-Based therapies: opportunities for immune-medicine beyond cancer. Nature Metabolism 4:163-9. DOI: 10.1038/s42255-022-00537-5