恶性脑胶质瘤,包括恶性程度极高的两种胶质瘤-GBM(胶质母细胞瘤)和DIPG(弥漫性内生脑桥胶质瘤),通常都在大脑重要区域内呈浸润性生长,治疗困难,致死率极高,是最常见的脑瘤发病类型,也是最容易复发的类型。脑胶质瘤复发率几乎为100%,1、2级的脑胶质瘤从治疗后到复发的间隔相对较长,但对3、4级的病人来说,可能很快就会复发。
胶质瘤广泛的肿瘤异质性、癌细胞的可塑性和存在癌症干细胞,使得胶质瘤治疗效果不好,预后极差。尽管CAR-T治疗脑瘤的临床研究结果显示出前景,但同时也带来了许多挑战,包括:
① 疗效持续时间短:CAR-T治疗后中位生存不足1 年,面临短期内再复发或进展;
② 单靶点CAR的局限性:易发生肿瘤抗原逃逸阴性复发;
③ 安全性有待提高:二代、三代CAR-T细胞可能诱导严重细胞因子释放综合征(CRS)和CAR-T相关中枢毒性(CRES)不良反应,高达12-40%。
因此,研发新一代安全有效的CAR-T细胞技术和更好的治疗方案以推动其在脑瘤中的应用迫在眉睫。
美国临床肿瘤学学会(ASCO)于2016年发布《2016年临床癌症进展:ASCO癌症研究进展年报》,将免疫治疗评为2015年癌症研究的最大进展。国内外许多机构纷纷开始进行相关的技术开发与临床试验,包括国际大厂 Novartis, Kite, Juno, Pfizer等。而国内自行开发或合作开发技术的单位,也声称已经具有了成熟的CAR-T技术,然而大多数的研发都聚焦在血液肿瘤上,对于实体肿瘤的CAR-T治疗还有待新技术的开发与突破。由于肿瘤异质性以及复发的问题,从2016年开始,深圳市免疫基因治疗研究院就开展了同时靶向两个以上靶点的CAR-T,并且进行了多项临床试验。因此,单靠一种武器(单靶向CAR-T)肯定在治愈肿瘤上会有不足,多靶点将是免疫治疗发展的必然方向。
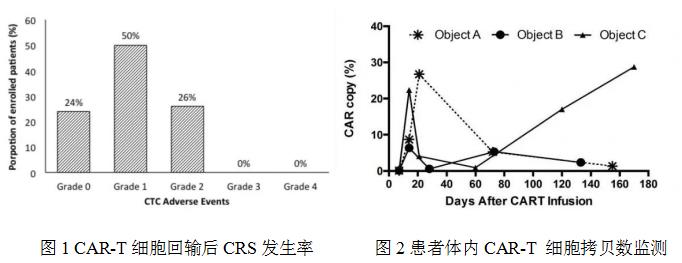
研究院多年研究发现,CAR-T细胞只需要静脉输注即可通过血脑屏障进入大脑,且效果不比脑瘤内直接注射CAR-T差。同时发现许多脑瘤患者稳定高表达PSMA、GD2 、CD70和CD56等新的脑瘤相关抗原。第4代GD2-4sCAR-T治疗实体瘤的研究成果显示,接受CAR-T治疗一年后的中期反应评估中24%的患者未观察到细胞因子释放症状(CRS 0级),76%的患者仅表现为1-2级温和可控的CRS,没有1例患者出现严重CRS症状,充分展现了第4代CAR安全性优势(图1)。通过检测CAR-T细胞回输后,外周血CAR拷贝数扩增动力学发现:大部分患者在回输后130天仍然可监测到CAR-T细胞的存在。有的患者在CAR-T回输后180天仍能检测到高达30%拷贝数,充分表明第4代CAR的长期有效性优势(图2)。
观察发现,多靶抗原CAR-T细胞,对治疗防止抗原阴性复发有良好作用。另一方面,结合DC疫苗,或可极大地解决了脑瘤异质性问题,联合治疗对改善体内抗肿瘤免疫反应的长期维持或是关键。在研究院协助治疗的脑瘤病人中,多例临床疗效良好,甚至取得了完全缓解。以下就一些案例进行介绍:
案例一:
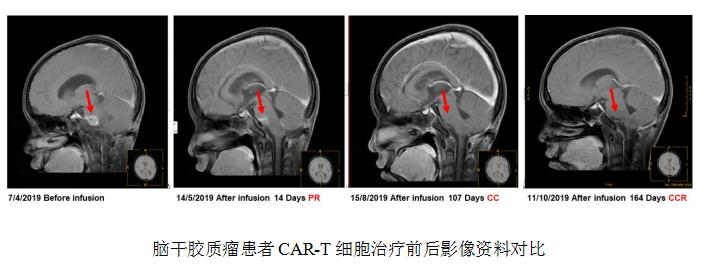
一位11岁男童诊断出儿童型脑干胶质母细胞瘤。术后3个月MRI显示桥脑内片状异常信号影,为残余肿瘤,大小约2.2cmx2.0cm。经染色分析肿瘤抗原后,病人接受了多靶点CAR-T免疫治疗。在采用GD2和PSMA双4SCAR-T输注后无不良反应,仅在第四天有些微白细胞降低(2.13 G/L),第7天后即恢复正常,在第14天后,患者在影像放射学上检测发现肿瘤部分缓解,肿瘤大小约为1.8cmx2.0cm。2个月后,患者进行了一次加强输注PSMA 4SCAR-T细胞,之后精神状态越来越好,CAR-T治疗前的乏力情况也有好转。在第一次输注CAR-T细胞的107天后,MRI显示脑瘤完全缓解,在164天MRI显示持续缓解状。患者CAR-T治疗后追踪记录稳定维持了258天。
案例二:
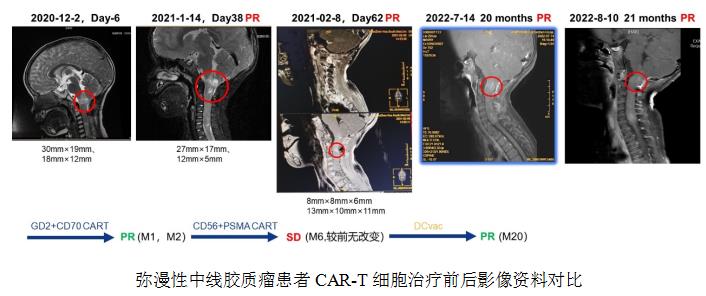
一名3岁男童被诊断为弥漫性中线胶质瘤,WHO IV级,H3K27M阳性。并伴随1型神经纤维瘤。患者肿瘤术后1个月复发。术后5个月MRI显示延髓肿瘤复发,大小分别为30x19mm和18x12mm。染色分析肿瘤抗原后,病人接受了多CAR-T免疫治疗。进行GD2和CD70双4SCAR-T输注,预处理开始后患者腹痛胃口变差,恶心呕吐,使用止吐药情况有好转,两周后食欲恢复正常。在CAR-T输注后第38天,影像学检测肿瘤部分缓解(PR),肿瘤大小分别为27x17mm和12x5mm。开始联合使用PD-L1和贝伐单抗。在第70天,患者进行加强输注CD56和PSMA 4SCAR-T细胞,病灶继续缩小到8x8mm和6x7mm。之后联合输注DC疫苗巩固治疗。CAR-T治疗后至今已稳定维持PR状态21个月。
案例三:
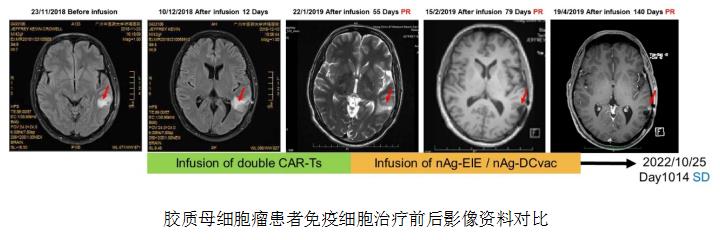
第3例成人患者被诊断为胶质母细胞瘤,WHO IV级,术后3个月脑瘤复发,立即规划进行多种免疫细胞联合治疗。患者首先接受CD70和PSMA双4SCAR-T细胞,输注后无不良反应发生,56天后影像学检查达到PR。在CAR-T治疗后62天,患者接受肿瘤特异性新抗原(neoAg)靶向T细胞(CTL)治疗。48、109、245天后又行肿瘤特异性抗原T细胞注射治疗,MRI影像检查证实肿瘤消退。之后患者隔月注射nAg-DC疫苗共4次。四年来,患者病情持续维持稳定(SD)。
这些用于治疗脑瘤的多靶点CAR-T治疗的早期结果表明,多靶点4SCAR2.0治疗方案安全性高,反应率良好。同时,GD2、PSMA、CD70和CD56可能是脑瘤多CAR-T联合治疗的良好靶点。临床观察显示,多CAR-T方案可以有效减缓脑瘤的病情。因此,对于控制脑瘤进展,期望达到长期缓解不复发,采用联合免疫治疗应该是改善总体生活品质与生存率的最佳途径。