大B细胞淋巴瘤(LBCL)是一种难治的恶性血液肿瘤。LBCL包括弥漫性大B细胞淋巴瘤、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤、滤泡性淋巴瘤3B级。多达40%的患者在首次接受治疗后出现耐药或复发。目前LBCL标准的一线治疗方案为利妥昔单抗加环磷酰胺、长春新碱、阿霉素和泼尼松,即广泛应用的R-CHOP方案。
临床上,高剂量化疗后进行自体干细胞移植一直是二线治疗的主要手段。然而约一半的患者由于年龄和并发症等原因,无法接受干细胞移植。这类患者的治疗选择非常有限,如果不进行治疗,复发/难治性LBCL患者的预期寿命只有3~4个月。更遗憾的是,有研究探讨了大剂量化疗(HDC)和自体干细胞移植(ASCT)作为一线治疗巩固治疗的作用,其2年无失败生存率(FFS)有所改善,然而5年总生存期(OS)未观察到明显差异。
近日,美国食品药物管理局(FDA)批准两种嵌合抗原受体(CAR)T细胞疗法,分别是Axicabtagene ciloleucel(Axi-cel Kite CD28)和Lisocabtagene maraleucel(Liso-cel Juno 4-1BB),治疗成人大B细胞淋巴瘤的原发性难治,或早期复发患者。
美国血液、骨髓移植和细胞免疫部主任弗雷德里克·洛克医学博士说,有三种情况下,患者应该尽早转诊接受CAR-T细胞治疗:
1. 第一种情况是一线治疗方案无效。病人在三个周期后接受断层扫描(PET)仍然有阳性的疾病。
2. 第二种情况是,当病人已经完成了一线治疗,但还是有肿瘤残留。
3. 第三种情况是,患者在完成一线治疗后的12个月内复发。
因为原发性难治疾病或早期复发可能表明该肿瘤的进展节奏很快,并且在生物学上是在快速复制的状态,早期CAR-T治疗也许是成功缓解的关键。
为什么要尽早接受CAR-T细胞治疗?两款FDA批准的CAR-T数据可以表明:
美国FDA首次批准CAR-T细胞的二线治疗是在2022年4月用于辅助治疗。其中Axi-cel CAR-T数据显示:治疗在一线化疗12个月内难治或复发的LBCL患者, 对照的标准治疗是两到三个周期的化疗,然后使用大剂量化疗配合自体造血干细胞移植。Axi-cel的两年无事件生存率(EFS)为41%,而标准化治疗的无事件生存率为16%,相当于EFS改善了60%。使用Axi-cel治疗的患者EFS中位数增加了四倍,达到8.3个月,相比之下,接受标准化疗的患者仅为2.0个月。且Axi-cels治疗的患者中有83%的患者对治疗有反应,65%的患者有完全缓解反应(CR)。
2022年6月,FDA还批准了Liso-cel CAR-T,用于治疗复发或难治性大B细胞淋巴瘤(R/R LBCL)成人患者。数据显示:将患者随机分配到Liso-cel CAR-T或标准化治疗,Liso-cel的EFS与标准化治疗相比增加了四倍多(10.1个月对应 2.3个月),相当于EFS提高了65%。在12个月时,接受Liso-cel CAR-T治疗的患者中有44.5%存活且无疾病,而接受标准治疗的患者只有23.7%。
这两项CAR-T随机对照研究说明了最重要的观点,证明CAR-T优于自体移植,从而改变了我们对这些高危复发/难治性LBCL患者的标准化治疗流程。
那临床医生该如何选择CAR-T呢?
FDA批准的两种CAR-T治疗方案,并没有进行对照试验,临床医生无法根据Axi-cel和Liso-cel之间疗效的差异做出治疗决定。然而,可以透过诸如毒性、患者报告的结果等因素纳入决策。
从结构本身来看,Axi-cel的CAR结构,其细胞外部由靶向CD19的scFv域组成,并使用CD28共刺激域。Liso-cel也以CD19为靶点,但具有4-1BB共刺激结构域,并以连续的CD8和CD4成分剂量给药。因为共刺激结构的不同意味着这两种CAR-T疗法以不同的速度在体内扩增,并导致不同程度的毒性。具体来说,Liso-cel的增殖速度较慢,而CAR-T细胞在患者体内的存活时间可能更长。相反,Axi-cel增殖迅速,但在回输后具有较高的细胞毒性。
在Liso-cel的临床报告中,约有一半的患者出现CRS,但≥3级反应仅为1%。未发生4级或5级CRS或神经系统事件;反观在Axi-cel项目中,6%的患者发生了≥3级CRS,21%的患者发生了≥3级神经系统事件。此外,与Axi-cel不同,Liso-cel也被批准用于一线化疗免疫治疗无效或一线治疗后复发的患者,对于不符合移植条件的患者,无论何时复发,都可给予Liso-cel CAR-T。
然而Axi-cel有较快的制备时间,相比之下,在美国,从白细胞分离到CAR-T产品制备完的天数平均为23天(还有更长的需要52天)。在Axi-cel中,从白细胞分离到产品放行平均为13天。如果患者正在进展,而医生无法桥接治疗,这将是一个重要的考虑因素。
再来费用考量也是一个因素,Axi-cel或Liso-cel的估计成本约为400,000美元,其中还不包括输液相关成本、白细胞分离术、桥接皮质类固醇和调节性化疗的成本。而这种治疗的毒性反应仍然是某些患者的一个障碍。毒性反应的致病率和死亡率仍然显著,这意味着有很多病人需要住院接受治疗和观察,这是一个重要的经费支出。
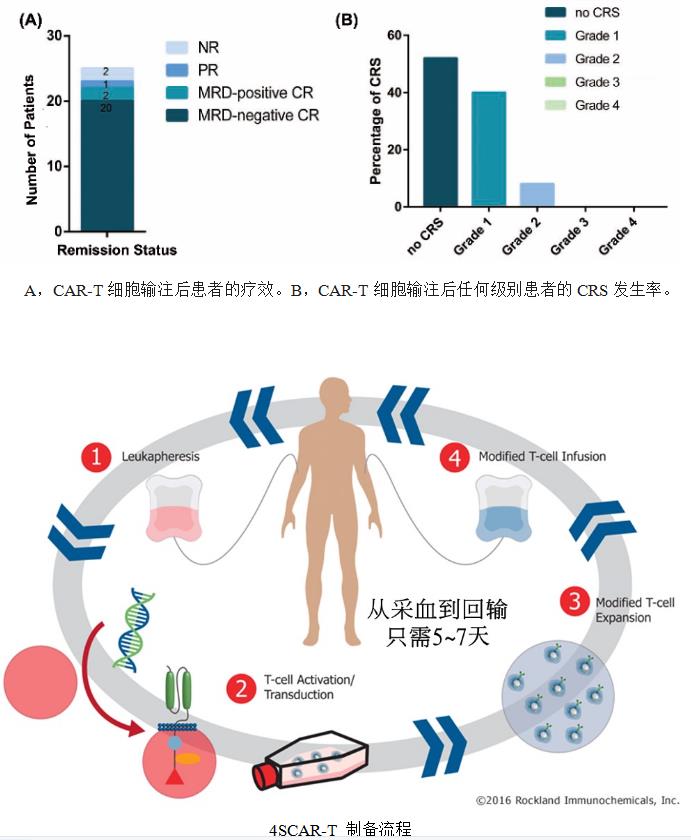
但我们提出还有第三种选择,深圳市免疫基因治疗研究院(GIMI)已经开展张隆基教授发明的四代CAR-T技术多年,于2013年起进行多项CAR-T临床实验,也已经发表许多成果,统计显示四代CAR-T安全性显著提高,3级或以上CRS(CRES)小于2%,多半病人不发生免疫因子风暴反应,而且有效性不低于上述FDA核准的二代或三代CAR-T。且制作时间短,仅需要5-7天时间即可达到CAR-T制剂放行标准。最重要的是,治疗费用不到Axi-cel或Liso-cel的1/20。
我们相信,不断研究和临床试验是推动科学进步和帮助患者找到最佳用药治疗的关键。CAR-T细胞在肿瘤治疗的应用还有许多未知,但也确实观察到明确有效反应。无论是肿瘤生物学还是T细胞免疫学,二者往往是相互关联的。经由不断对CAR-T技术的优化,和把握关键治疗时机、方案, CAR-T细胞治疗领域将快速向前推进。
摘录整理:
This or That: Considerations for Selecting a Second-Line CAR
By Leah Lawrence - September 13, 2022