Our Institute
Clinical Trials
Our Science
News
International Patients
- International Patients
- International patient Service Care
- Travel Arrangement and Hospital Admission
- FAQ
- Contact Us
摘要:使用CD19诱导CAR-T细胞的成功临床,激励很多学术机构探索自行生产CAR-T细胞的可行性。本文回顾了为了实现这一目标必须解决的问题。它包括生产基础设施、监管环境,生产实际应用和成本。
1、 简介
细胞疗法用于治疗多种疾病已经有多年时间了。有一些令人鼓舞的案例,例如,病毒特异性T细胞用于预防和治疗免疫缺陷个体的病毒感染,最近10年最令人引以为傲的是实现了CAR-T细胞用于治疗白血病的审批。FDA给予了CAR-T细胞生产许可证,它激励了研究人员使用CAR-T细胞来治疗其他恶性疾病。这个检验的最终结果是用早期阶段的临床治疗去评价新CAR-T细胞的安全性和有效性。FDA强制要求在这些细胞必须在IND批准的条件下生产,并且这些细胞的生产必须符合CGMP的要求。GMP提供了这样一个系统:细胞是在可控的、可审计的、可复制的环境下制备的才是安全的和潜在有效的产品。很多机构对这些法规和合规水平要求并不熟悉。以下的部分重点指出了在做决定时需要考虑的问题。
2、 GMP法规——什么样的要求?
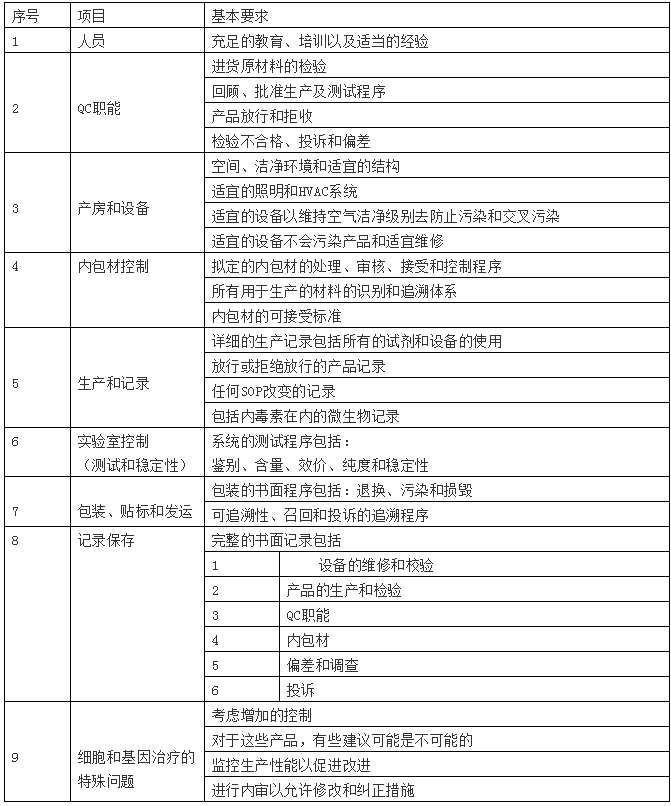
GMP法规在21CFR多个章节中体现,法规覆盖了多种产品包括:食品,小分子药物等等。关于CAR-T细胞的相关章节在210和211章节呈现,一些附件信息在第600章节。当你第一次阅读时,这些语言显得生涩难懂,但是通过实践,可以清晰的了解“FDA法规”传递出特定的概念,理解这些将使你与FDA交流更容易。法规的综合性质是:第一,权威性,但是早期的临床治疗生产要求的简要总结在FDA指南“第一期临床试验药物CGMP指南”中体现。关键领域的讨论在表1中体现,包含一个特殊的章节,它涵盖了细胞和基因治疗产品。
已经有GMP设施机构将会与熟悉这些法规。不这样做的话,不得不考虑一致性的成本以及建造和维修的空间要求。这方面的核心是预期生产的产品数量,一个繁忙的厂区能维持收支平衡,然而具有优秀性能的厂区应考虑到资源浪费,因为即使没有生产任务厂房也应当被维护。
表1 一期临床试验药品CGMP的FDA指南公布的关键项目
3、 厂房
一旦决定新建一个厂房,设计问题是主要的问题。第一个需要决定的是采用人员、物料、产品和废物的单行还是混合流的选择。这就引出了产品潜在的污染和交叉污染的问题。混合流提高了空间有效利用率,而单向流设计降低了污染风险,但是需要大量的空间来创造分离洁净和肮脏的走廊。设计计划可以提交给FDA并在建设开始前获得反馈。近来使用混合流的方式建设CAR-T细胞厂房是可以获得批准的。
当产品被生产并在不同的国家使用那么空气处理设计就变得很重要了。在U.S.A.允许在万级(ISO 7级)车间的百级(ISO 5级)生物安全柜中生产细胞治疗产品。在欧洲生物安全柜要求在千级(ISO 6级)房间,与万级区域相邻。
应考虑到使用的生产技术。现在的趋势是用生物反应器来替代传统的基于烧瓶培养CAR-T细胞的产品以便减少劳动。用密闭生物反应器(密闭功能)能减少对高级别房间的要求,同时减少污染的风险。在适当的程序下,在单独的房间内放置几个生物反应器。当在一个大车间内同时生产多种产品时,应建立书面的转化程序减少产品发生污染和交叉污染的风险。可以通过供者白细胞抗原来检测CAR-T细胞的交叉污染,在产品放行前应保证CAR细胞被鉴别出来。
应考虑T细胞转染的操作。由于CAR治疗的多样性有希望增加,可以使用单独的BSC/培养箱/生产场地来操作病毒载体,最核心的问题是交叉污染,必须建设厂房和SOPs来防止这样事情发生。
4、 人员和培训
CAR-T细胞的生产不需要任何特殊的和专业的技术,除了优异的无菌技术。所涉及到的生产和制造步骤与其他细胞治疗产品并没有不同,不同点可能来自对淋巴细胞的基因修饰系统。转染试剂来源会增加问题的发生,无论他们是内部生产还是别处制造的。如果已经决定在内部生产试剂,这就要求建立和维持一个GMP区域专注于这件事,这就超出了这篇文章的范围。另外一种选择,一些学院机构和生物医药公司提供这样载体生产服务,学院机构提供的产品比生物医药公司要便宜得多,但是由于其高要求,需要等待的时间要长得多。这两者对细胞库和载体的测试要求都是熟悉的,而这些都是大量的、昂贵的并且随时间改变而改变的。
员工培训必须是彻底的和文件化的。重要的是让他们了解遵守SOPs的重要性,但也能在细胞培养过程中发现问题。这是一种洞察力,而不是一种可以传授的能力,不幸的是,这需要时间来开发。
5、GMP条件下的CAR-T细胞生产
5.1总论
在设计CAR-T细胞的生产SOP时,一个明智的举动是特别注意开发一个密闭的或者密闭功能的生产流程,去减少产品被污染的风险。可实现的方法是:细胞培养袋,无菌链接管件,新的自动化和半自动化细胞培养系统来实现(图1)。
要想在美国生产CAR-T,你要先向FDA申请IND并获得批准才能开始临床试验。CMC是申请的一部分,它涉及到生产厂房,材料的使用,产品,检验程序产品管理的详细细节。为了加快审核遵守FDA的“人体细胞治疗INDs的内容和综述的CMC要求”是非常重要的。应提供一个CMC的模板并指明要求的信息并说明生产实现过程。有第二次机会获得“人体细胞治疗INDs的内容和综述的CMC要求”的指导,为载体和基因治疗产品提供相似的建议。作为CMC的一部分,你必须提供给FDA以下信息:用于细胞生产的试剂和原材料,生产SOPs,用于放行的检验规程,产品冷冻和溶解的稳定性检验计划,产品的发运和转运信息。原材料和试剂应采用临床级别的,如果不是的话,在CMC部分应有供应商的COA文件,FDA将决定这样的试剂是否可用于临床生产。应采用FDA批准的方法,如果不是的话应对这些方法进行验证。虽然在开展三期临床之前没有严格要求,加入一些效价检验是明智之举。在一期临床阶段,细胞的作用机制可能并没有完全被完全理解。效价测试的FDA指南提供了有用的信息(细胞和基因资料产品的效价测试)。一旦CMC被批准,在没有通知FDA之前,不应进行重大变更。微小变更可以在IND年度报告中阐述。
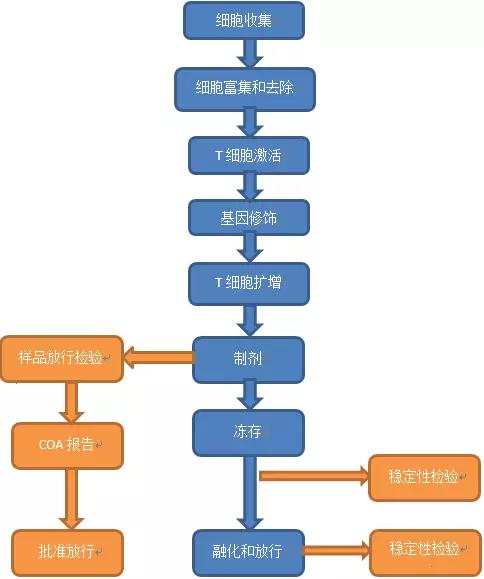
图1 CAR-T细胞生产的主要流程
5.2 细胞收集
多数工厂使用收集的白细胞作为材料生产CAR-T细胞。有些中心使用收集的移植造血细胞,用适当的方法收集CD34阳性造血细胞。不是直接调用供者T细胞用于生产,确定最优化T细胞产量的工作正在进行中。单采采用的是密闭功能的系统,能减少产品污染。影响产量的主要变量是供者自身的健康状况。疾病状态和以前的治疗可能导致单核细胞和粒细胞的低收集效率和高污染。最近的报道显示采用97%单采供者的最小T细胞数有77%达到了目标剂量。15%的供者发生了单采并发症,但是在临床上是容易管理的。
在开始CAR细胞生产之前,要从单采血中清洗掉用于收集细胞的试剂。红细胞和血小板污染物要被去除,并使用如Lovo细胞清洗机、Terumo COBE2991、Sepax等设备进行单核细胞的富集。
T细胞的替代来源包括外周血,通常采用密度梯度分离法在Ficoll-Hypaque上分离单核细胞,以及分化诱导多功能干细胞。
5.3 T细胞富集/分选
单采血的纯度影响最终产品的产量。这可以通过CFE的方法去除潜在的抑制细胞群,例如单核细胞和粒细胞,CFE原理:当离心力作用于悬浮细胞混合物的缓冲液的流动平衡时,细胞根据大小排列。使用CFE的方法进行淋巴细胞的富集结果是改善GD2CAR-T细胞的最终数量,但是同样的影响在CD19 CAR-T细胞中没有发现。可以采用磁珠分选的方法在Miltenyi CliniMACs和Prodigy设备上进行T细胞亚群(CD4/CD8/CD25等)的富集。这得益于抗原效应的GMP级别单克隆抗体的应用。特殊的T细胞亚群,例如:naïve,central menmory和memory T cells,在CAR-T细胞启动时具有功能优势。
5.4 激活
可溶性抗CD3单克隆抗体有益于T细胞激活。然后发现它的效率低于固定化单抗,并发现其优先作用于CD8阳性细胞。T细胞激活最初是通过激活因子通过自身抗原呈递细胞来实现的,例如DC细胞。APC的生产是冗长的并且其效率是可变的。另一种选择是使用K562,慢性髓性白血病细胞系,该细胞系经过基因改造以表达所需的共刺激配体,并被用作抗原呈递细胞的来源。在K562细胞使用前,需要花费时间来生产改造后的K562系细胞库,并进行广泛和昂贵的病毒污染测试。一种通用而经济的替代方法是使用固定化抗体与CD28结合来激活CD3。抗体通常吸附在塑料表面,例如:培养容器、免疫磁珠(磁珠,人T激活剂)或默天旎TransACT。磁珠用于细胞的有效激活,并提供一种细胞富集的方法。磁珠激活的比较方法系统已经被发布。如果使用微磁珠,用使用永磁铁去除这些磁珠。默天旎磁珠是非常小和生物适用性的并不需要被去除,然而过量的微球可以通过清洗的来去除。其他激活试剂在商业上是可用的,例如:人CD3/CD28 T细胞激活剂(干细胞技术)。这包括可以结合CD3和CD28表面配体的可溶性四聚体抗体复合物。这些试剂的监管批准状态各不相同,各用于临床生产的使用者应根据公司和FDA要求进行检验。报道显示Expamer(Juno医疗)是成功的激活剂,一种溶性链球菌蛋白寡聚体,具有激活原配体(抗CD3和CD28 Fab片段)的功能,用于多克隆刺激T细胞。StrepTactin 骨架允许通过低亲和性Fab片段的关联来实现可逆和模块化的功能化。这些试剂是可溶的并可通过清洗细胞来去除。使用ExpAct磁珠来激活CD25阳性T细胞群来富集T-reg细胞,并使用含有Rapamycin的培养基进行培养。
5.5 转染
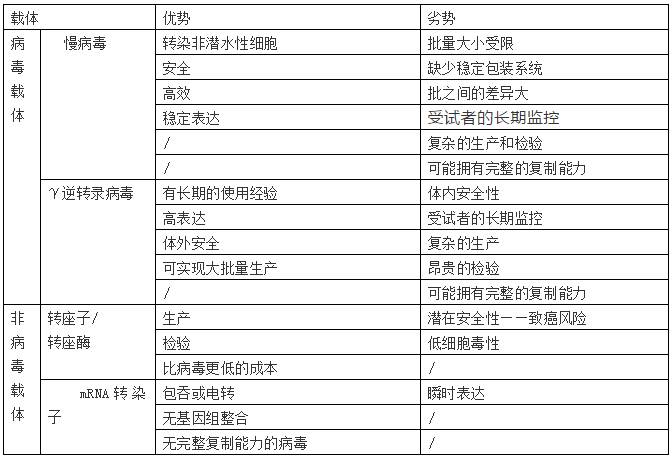
使用慢病毒和γ逆转录病毒载体来对T细胞进行基因改造是最常用的方式,当然非病毒的方法选择正在增加,例如:转座子和转座酶。载体的选择,生产和大量测试不在本文的讨论范围。
表2 T 细胞转染载体的使用
5.6 扩增
基因改造后,CAR-T细胞的体外扩增要达到临床使用数量的要求。大量的系统被使用,从简单的T型瓶到细胞培养袋再到复杂的生物反应器生产。理想的系统应具有密闭功能,减少污染的风险,因此大量的研究人员放弃了使用T型瓶。现在,使用最广的设备是G-Rex(Wilson Wolf 生产)、Wave Bioreactor(GE life Systems)和CliniMACS Prodigy (Miltenyi Biotec)。
G-Rex是可伸缩的圆柱形静态培养设备,T细胞被培养在涉笔底部通气膜上,并且部分填充培养基。当细胞增殖时,用葡萄糖的消耗和乳糖产生测量培养基消耗。生长是可预期的,细胞可以用GatherRex(Wilson Wolf 生产)来收获。它是一个封闭系统设备,从培养物中提取上清。细胞通过旋转G-Rex来重新悬浮,GatheRex将悬浮和清洗的中间体收集到转移袋中,用于下游处理。
Xuri(Wave)生物反应器是自动、密闭系统是由放置在摇动平台上可透气的细胞培养袋组成。系统由质子流量计、二氧化碳和氧气浓度压力探头、PH和溶氧电极传送器组成。它被成功的用于生产CAR-T细胞。系统可以被用来生产1到1000升的产品。
Miltenyi 的CliniMACS Prodigy 被用于自动化生产CAR-T细胞的主要部件,Prodigy TCT工艺软件和TS520管路系统被用于细胞的分选、转染、清洗和扩增,所有这都是单独设置的。通过单采机获得的血小板在去除白细胞容器中重新复苏单核细胞。使用Prodigy设备,MACS CD4和CD8试剂用于细胞的分选,TransAct CD3和CD28试剂用于细胞的激活,使用CD19或CD19/CD20 Ab链的CD8 TM-41BB-CD3 zeta-cfrag慢病毒载体来转染细胞,然后在含有3% HS-IL2的TexMACS培养基中培养细胞,使用EDTA/PBS试剂进行清洗。使用Prodigy 洗去起始细胞中的血小板,并分选获得CD4+和CD8+ 细胞,其纯度能达到99%,产量为~-50%.分选的细胞有90%±12%是CD3阳性细胞。有大约10%非T细胞是CD8阳性 NK细胞,在通过CD3/CD28激活和扩增以后基本消除了这些洗吧。Prodigy可以将CD4阳性+CD8阳性细胞的分选数量控制在1*108个,在2个试验中,小规模的部分细胞在6孔板中培养用于激活和初次转染。用Prodigy进行三次生产,一个使用CD19病毒,2个使用CD19+CD20病毒。T细胞的转染效率在21%~46%范围内,大多数是CD4阳性细胞。扩增范围在26-40倍之间,所有CD19和/或CD20靶点细胞生产线都是通过基于铬51释放实验和γ干扰素实验来确认的。使用Prodigy和手工方法制备细胞对比实验显示相似的转染和表型。
自动化是CAR-T细胞前沿生产方式,很多生物技术公司都在开发他们自己的这类设备。这些设备可能符合他们的产品的专有的要求。有些设备,例如Prodigy,可能适用于学术医疗中心来为他们的患者生产他们的细胞。其他的设计是让公司或机构给卫星研究机构提供中心调度使用的生产和测试。最终会有各种各样的模型被开发。
使用任何设备都应当考虑的可变因素是培养基和补充剂的使用。前沿趋势是使用无血清培养基不包含异基因添加剂。好几家公司拥有他们自己的产品(例如:Stemline T cell expansion [Sigma-Aldrich]等)。这些产品只适用于特定的工艺。添加剂,例如:不同厂家的PH指示剂,抗生素和谷氨酰胺都不相同,而最佳的基础培养基应由研究者和制造商决定,并证明每种成分对细胞最佳生长的需要等。令人鼓舞的是现在商业制造商正在生产GMP级别的添加剂,例如细胞因子和生长因子。考虑到对CAR-T细胞生产的巨大兴趣,培养基和补充剂可能出现短缺,所以非常重要的事情是开发一个安全的供应链并在需求升高时验证可替代的资源。无论什么方法被研究者使用,都应根据被推荐的最终方案进行正式验证使其最优化。FDA已经出版了工艺验证指南。
5.7 冻存
冻存CAR-T细胞是为了长期储存。最长用的方法是根据造血干细胞开发的程序,将其重新悬浮在含10%的DMSO中,然后在气相液氮罐中储存。据报道这个程序可以维持CAR-T细胞的免疫表型和活性功能。但并不总是使用例如NK细胞。多年来,用于冻存的介质已经从研究级别向USP级别电解质溶液转变,例如添加了HSA的PlasmaLyte A。
6、生产失败
CAR-T细胞的生产失败率一般在2%-14%之间。主要困难是最终制剂满足要求的细胞数量。其他的问题包括,粒细胞和/或单核细胞对分离产品的高污染,大量预处理患者的T细胞数很少。当出现CAR细胞数少的情况,患者通常接受这样的剂量,并且低细胞数回输通常会复发。
7、放行检验
在GMP条件下生产的产品应在获得COA文件之后被放行,放行单列出执行的检验,使用的检验方法,设备,必须得到结果才能放行产品,实际结果是满足要求的。COA文件应包含:鉴别、纯度、活率和效价。虽然每个产品都是不同的,但是他们有共同的标准化检验。
7.1 活率
在冻存前通常立即检验细胞活性,例如:台盼兰、细胞计数仪、7-AAD染色法和流式细胞术。细胞活率必须大于70%。
7.2 鉴别
本检验是为了确认产品没有被其他产品污染,并保证产品的贴标正确。流式细胞术用来鉴别最终产品,对可能的污染物进行限制(纯度)。可以通过确认最终产品的HLA分型和自体供体的分型相匹配来检验交叉污染。
7.3 纯度
本检验是为了免于外来物质的污染确认。通常包括内毒素实验(例如使用Endosafe 快速检验设备)。FDA也可能检验:残留细胞因子、多肽、生长因子和血清。可能需要对这些物质进行定量分析,或者在生产过程中稀释细胞来实现有效去除。
7.4 效价
虽然效价检验是测量生物活性的,但严格来说,只要求在III期临床开始时实行,通常情况在I期临床试验时就包括了产品效价的分析。这是理想的定量方式,但是定量测试可能被接受。对于CAR-T细胞来说,最广泛使用的是对表达靶向抗原细胞系的细胞毒性分析,或通过激活靶向抗原产生的γ干扰素。
7.5 微生物检验
无菌检验最常用的方法是使用自动血培养仪,例如:Bactec(Becton Dickinson、Bact/ALERT 3D(bioMerieux)。FDA要求采用这种方法进行产品放行时应进行全面的验证,然而现在通常得到批准。建议进行好氧、厌氧和真菌检验,最少培养时间14天。
通常要求进行支原体检验。虽然培养法是官方认可的方法,聚合酶链式反应和快速商业化MycoAlert分析(Lonza)法可能会被接受。
7.6 稳定性实验
FDA希望生厂商开发稳定性实验项目。来讨论细胞产品在长期冻存和溶解后的完整性和功能性活性。这些数据通常在提交IND时不需要提供,但是作为正常研究的一部分来制定计划并收集数据。
7.7 产品放行和发运
在收到医生的书面处方后,CAR-T细胞才被放行。冻存的细胞通常由医护人员在病床边融化,并通过静脉注射给药。最新的治疗方案可能是在病灶点局部给药。如果产品是用的另外一个中心,应采用经过验证的方法:采用能维持-150℃的液氮运输在预期收到之日的48小时使用。
8、商业化和价值
2017年8月,FDA批准了Novartis CAR-T细胞治疗(Kymriah)用于治疗小儿和青少年B细胞急性白血病。紧接着在10月份批准了Kite Pharma的Yescarta细胞治疗产品,用于治疗难治复发的成人大B淋巴细胞白血病。这两种产品都是在患者接受治疗的机构采用单采机收集起始细胞的。新鲜细胞(Yescarta)或冻存细胞(Kymriah)被运送到公司的GMP车间进行制备CAR-T细胞,然后发送到治疗中心进行输注。问题是商业化来源能否满足产品的预期要求。鉴于目标是在自动的,密闭功能的设备中生产每个患者的细胞,且每个患者都需要一个系统,设备的可用性可能成为一个限制因素。
商业化产品的治疗费用大于37.3万美元,而其生产成本则小于4万美元。
9、总结
CAR-T细胞在治疗白血病方面的影响刺激了它在治疗实体瘤方面的探索应用。这个方面取得了快速的发展,仅在2017年在PubMed上就有417篇文章发表。同样的,细胞产品的生产也在快速的发展,本文只是起到了“快递”功能。CAR-T成功无疑刺激了新技术、试剂、原材料和设备的开发,甚至新的审批法规,所有这些都有可能将细胞疗法进一步推出医疗标准。
原文来源:Adrian P. Gee.GMP CAR-T cell production.Best Practice & Research Clinical Haematology